
【题目】氮化硅是一种高温陶瓷材料,它硬度大、熔点高,化学性质稳定,工业上普遍采用高纯硅与纯氮在1300℃反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是。(填序号)
a.制汽轮机b.制有色玻璃
c.制永久性模具d.制造柴油机
(2)写出N的原子结构示意图 , 根据元素周期律知识,请写出氮化硅的化学式。
(3)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应,试推测该陶瓷被氢氟酸腐蚀的化学方程式。
(4)现用四氯化硅与氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅,反应的化学方程式为。
【答案】
(1)acd
(2)![]() ;Si3N4
;Si3N4
(3)Si3N4+12HF=3SiF4↑+4NH3↑
(4)3SiCl4+2N2+6H2 ![]() Si3N4+12HCl
Si3N4+12HCl
【解析】氮化硅是一种高温陶瓷材料,具有硬度大,熔点高、化学性质稳定等优良性质,可用于制造轴承、汽轮机叶片、机械密封环、永久性模具等机械构件,N元素位于元素周期表第二周期第ⅤA族,Si元素则在第三周期第ⅣA族,非金属性应是N元素比Si元素强,其化学式可写为:Si3N4 , 氮化硅可被氢氟酸腐蚀,由Si3N4和HF的性质分析,可推知该反应不可能是一个氧化还原反应,其产物只能是SiF4和NH3。SiCl4、N2、H2加强热时反应产物之一是Si3N4 , 可知N2作为氧化剂参与反应,那么还原剂只能是H2 , H2的氧化产物只能是HCl。


科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下面是八种短周期元素的相关信息(已知铍的原子半径为0.089nm)
元素代号 | A | B | C | D | E |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6,﹣2 | ﹣1 | ﹣2 |
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色.
(1)C元素在元素周期表中的位置 . B形成的简单离子的结构示意图 .
(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是(填化学式).
(3)用电子式表示A、D形成化合物的过程: .
(4)H、E形成原子个数比为1:1的化合物中所含化学键类型为 .
(5)GE2的电子式为 , F与G形成的最简单的化合物的结构式为 .
(6)E的氢化物比C的氢化物的熔沸点高的原因是 .
(7)A、B、C、E原子半径由大到小的顺序为(用元素符号表示) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚四氟乙烯的耐热性和化学稳定性都超过了其他塑料,号称“塑料王”,在工业上有广泛的用途,其合成途径如下图所示: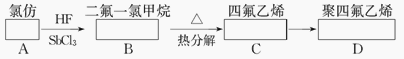
(1)在方框中填入合适的有机物的结构简式。
(2)写出下列反应化学方程式:B→C、C→D。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用.CeO2在稀硫酸和H2O2的作用下可生成Ce3+ , CeO2在该反应中作剂.
(2)自然界Cr主要以+3价和+6价存在.+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬.完成并配平下列离子方程式:
Cr2O72﹣+SO32﹣+=Cr3++SO42﹣+H2O
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是 .
(4)NiSO4xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如下: 
①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为
②对滤液Ⅱ先加H2O2再调pH,调pH的目的是 .
③滤液Ⅲ溶质的主要成分是NiSO4 , 加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4 , 这两步操作的目的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:
[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3 .
请回答下列问题:
(1)C,N,O的电负性由大到小的顺序为 , 基态Fe原子的价电子排布图为 .
(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是 , 与CO互为等电子体的分子的电子式为 .
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是 , 配体中提供孤对电子的原子是 .
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有形成.
a.离子键 b.配位键 c.非极性键 d.δ键
(5)NaAlH4晶体的晶胞如图,
与Na+紧邻且等距的AlH4﹣有个;NaAlH4晶体的密度为gcm﹣3(用含a的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.23 g Na与足量H2O反应完全后可生成NA个H2分子
B.1 mol Cu和足量热浓硫酸反应可生成NA个SO3分子
C.标准状况下,22.4 L Cl2含NA个原子
D.3 mol单质Fe完全转变为Fe3O4 , 失去8 NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能量变化的说法正确的是
A. 冰融化成水放出热量B. 生成物的总能量一定低于反应物的总能量
C. 金属与酸反应吸收能量D. 化学键的断裂和形成是化学反应中能量变化的主要原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,缓慢通入O2 , 用水吸收NO2(假设每次通入的O2能完全反应).下列说法正确的是( ) 
A.当试管内溶液的pH值不再变化,说明NO2全部转化为HNO3
B.当试管气体不是红棕色时,说明NO2全部转化为HNO3
C.水槽内的水改为稀盐酸,有利于吸收NO2
D.水槽内的水改为稀NaOH溶液,有利于吸收NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既表现硝酸的酸性,又显示硝酸的氧化性的是
A. CuO+2HNO3=Cu(NO3)2+H2O B. FeO+4HNO3=Fe(NO3)3+2H2O+NO2↑
C. C+4HNO3=CO2↑+2H2O+4NO2↑ D. NH3+HNO3=NH4NO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com