
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
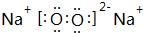 ,灼烧Na2O2时,火焰呈特殊颜色,产生该现象的原因:在加热条件下,低能级电子跃迁到高能级,不稳定,电子由高能级跃迁回低能级,能量以光波形式释放,使火焰呈现特殊颜色,
,灼烧Na2O2时,火焰呈特殊颜色,产生该现象的原因:在加热条件下,低能级电子跃迁到高能级,不稳定,电子由高能级跃迁回低能级,能量以光波形式释放,使火焰呈现特殊颜色, ;在加热条件下,低能级电子跃迁到高能级,不稳定,电子由高能级跃迁回低能级,能量以光波形式释放,使火焰呈现特殊颜色;
;在加热条件下,低能级电子跃迁到高能级,不稳定,电子由高能级跃迁回低能级,能量以光波形式释放,使火焰呈现特殊颜色;| 5+1-3×2 |
| 2 |
 ,
, .
.


科目:高中化学 来源: 题型:
 Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.
Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
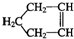 可简写为
可简写为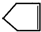 .降冰片烯的分子结构可表示为:
.降冰片烯的分子结构可表示为: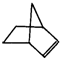
查看答案和解析>>
科目:高中化学 来源: 题型:
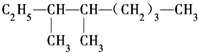 的系统命名法名称是
的系统命名法名称是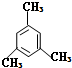 的名称是
的名称是查看答案和解析>>
科目:高中化学 来源: 题型:
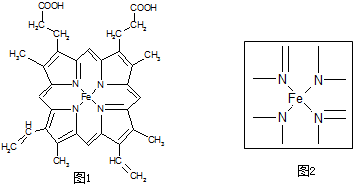
查看答案和解析>>
科目:高中化学 来源: 题型:
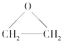 ),该反应的原子利用率为100%,反应的化学方程式为
),该反应的原子利用率为100%,反应的化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
| 类型 | 酸性氧化物 | 电解质 | 非电解质 |
| 化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
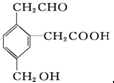 ,它在一定条件下可能发生的反应有( )
,它在一定条件下可能发生的反应有( )| A、②③④ | B、①③⑤⑥ |
| C、①③④⑤ | D、①②③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com