
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g)+H2O(g) CO(g)+3H2(g) △H=+206.0kJ?molˉ1
CO(g)+3H2(g) △H=+206.0kJ?molˉ1
II:CO(g)+2H2(g) CH3OH(g) △H=-129.0kJ?molˉ1
CH3OH(g) △H=-129.0kJ?molˉ1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为 。
(2)将1.0mol CH4和1.0mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图。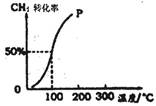
①假设100℃时达到平衡所需构时间为5min,则用H2表示该反应的平均反应速率为 。
②1000C时反应I的平衡常数为 。
(3)在压强为0.1 MPa、温度为300℃条件下,将a molCO与2a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器舶容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
| A.平衡常数K增大 | B.正反应速率加快,逆反应速率减慢 |
| C.CH3OH的物质的量增加 | D.重新平衡c(H2)/c(CH3OH)减小 |

(16分)(1)CH4(g)+ H2O(g) CH3OH(g)+H2(g) △H=+77.0kJ?molˉ1(3分,焓变写错扣1分,用等号不扣分)
CH3OH(g)+H2(g) △H=+77.0kJ?molˉ1(3分,焓变写错扣1分,用等号不扣分)
(2)0.003mol?Lˉ1?minˉ1(2分,单位写错0分) 6.75×10ˉ4(2分)
(3)C、D(共2分,只答对一个给1分,答错一个0分)
(4)O2+2H2O+4eˉ=4OHˉ或3O2+6H2O+12eˉ=12OHˉ(3分,电极反应式没配平0分) 负(2分) 6(2分)
解析试题分析:(1)根据盖斯定律可知,已知反应I+II可得:CH4(g)+ H2O(g)= CH3OH(g)+H2(g) △H=+77.0kJ?molˉ1;(2)CH4的起始浓度为1.0mol÷100L=0.01mol?Lˉ1,读图可知100℃时其平衡转化率为50%,则CH4的变化浓度为0.01mol?Lˉ1×50%=0.005mol?Lˉ1,则v(CH4)= 0.005mol?Lˉ1÷5min=0.001mol?Lˉ1?minˉ1,根据系数之比等于速率之比可知,v(H2)=3×v(CH4)= 0.003mol?Lˉ1?minˉ1;根据变化浓度之比等于系数之比,则反应I:
CH4(g) + H2O(g)  CO(g) + 3H2(g)
CO(g) + 3H2(g)
起始浓度/ mol?Lˉ1 0.01 0.01 0 0
变化浓度/ mol?Lˉ1 0.005 0.005 0.005 0.015
平衡浓度/ mol?Lˉ1 0.005 0.005 0.005 0.015
K=[c(CO)?c3(H2)]/[c(CH4)?c(H2O)]= [0.005×0.0153]/[ 0.005×0.005]=6.75×10ˉ4
(3)反应II是气态物质体积减小的反应,缩小容器体积,能增大各组分浓度,也能增大压强,平衡向正反应方向移动,但是平衡常数保持不变,因为温度不变平衡常数K不变,故A错误;同时增大反应物和生成物的浓度,正、逆反应速率均增大,但是v(正)>v(逆),所以平衡右移,故B错误;增大压强平衡右移,使生成物的量增加,故C正确;增大压强平衡向正反应方向移动,反应物浓度减小,生成物浓度增大,则重新平衡后反应物浓度/生成物浓度的值减小,故D正确;(4)甲醇完全燃烧生成CO2和H2O,CO2和过量KOH反应生成K2CO3和H2O,则该电池负极的主要反应物和产物分别是CH3OH、CO32ˉ,碳元素由-2价升为+4价,则CH3OH-6eˉ→CO32ˉ,由于KOH是强碱,应该用OHˉ使左右电荷守恒,则CH3OH-6eˉ+8OHˉ→CO32ˉ,根据氢、氧原子个数守恒可得,负极反应式为CH3OH-6eˉ+8OHˉ=CO32ˉ+6H2O或2CH3OH-12eˉ+16OHˉ=2CO32ˉ+12H2O;而正极的主要反应物是O2,同理可推断正极反应式为O2+2H2O+4eˉ=4OHˉ或3O2+6H2O+12eˉ=12OHˉ;放电时负极流出电子,正极流入电子,则阴离子移向负极,阳离子移向正极,则溶液中的OHˉ移向负极;根据系数之比等于物质的量之比,则1mol甲醇完全反应失去6mol电子,因此该燃料电池转移6mol电子。
考点:考查化学反应原理,涉及热化学方程式的书写、盖斯定律的应用、平均反应速率的计算、平衡转化率和化学平衡常数的计算、化学平衡、燃料电池的工作原理等知识。


科目:高中化学 来源: 题型:问答题
工业上可以利用废气中的CO2为原料制取甲醇,其反应方程式为:CO2+3H2 CH3OH+H2O。请回答下列问题:
CH3OH+H2O。请回答下列问题:
(1)已知常温常压下下列反应的能量变化如下图所示:
|
|
|
|

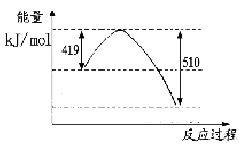 写出由二氧化碳和氢气制备甲醇的热化学方程式__ _。
写出由二氧化碳和氢气制备甲醇的热化学方程式__ _。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(12分)在一容积为2L的密闭容器中加入2molA和6molB,保持温度为20℃,在催化剂存在的条件下进行下列反应:A(g)+2B(g)  2C(g),达平衡后生成1.2mol C,平衡混合气体中C的体积分数为ω。
2C(g),达平衡后生成1.2mol C,平衡混合气体中C的体积分数为ω。
⑴求20℃时,该反应的平衡常数K(保留三位有效数字)
⑵20℃时,若在同一容器中加入1molA、 mol B和 mol C,则平衡混合气中C的体积分数仍为ω。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
在恒温时,向某密闭容器中通入2mol X和1mol Y气体,发生如下反应:
2X(气)+Y(气)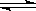 2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。
2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。
(1)与上述平衡保持同温、同压,若向密闭容器中通入4mol X(气)、2mol Y(气),达到平衡,则Z的体积分数为 ;平衡时,气体的总物质的量是 。
(2)若向密闭器中通入X(气)和Y(气)的物质的量分别记为n(X)、n(Y),保持容器容积不变,并满足平衡时Z的体积分数为0.4,则n(X)/n(Y)的取值范围为 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
工业制硫酸时,利用催化氧化反应将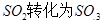 是一个关键的步骤。
是一个关键的步骤。
(1)某温度下,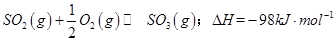 。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
(2)一定条件下,向一带活塞的密闭容器中充入2mol mol
mol ,发生反应:
,发生反应: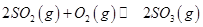 ,达平衡后改变下述条件,
,达平衡后改变下述条件, 气体平衡浓度都比原来增大的是____________(填字母)。
气体平衡浓度都比原来增大的是____________(填字母)。
A.保持温度和容器体积不变,充入2mol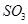 |
| B.保持温度和容器体积不变,充入2molN2 |
C.保持温度和容器内压强不变,充入1mol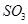 |
| D.移动活塞压缩气体 |
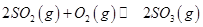 反应的图像中,不正确的是_________。
反应的图像中,不正确的是_________。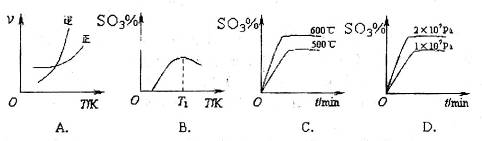
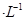 的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH="__________" (忽略溶液体积变化)。
的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH="__________" (忽略溶液体积变化)。 查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(I)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
①CaBr2+H2O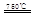 CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg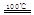 HgBr2+H2
HgBr2+H2
③HgBr2+_____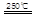 _____ + ④2HgO
_____ + ④2HgO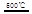 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:________ _。
根据“绿色化学”的思想评估该方法制H2的主要缺点:________ __。
(II)氢气常用生产水煤气的方法制得。CO(g)+H2O(g) CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K______1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0molCO、3.0molH2O、1.0molCO2和x mol H2,则:
①当x = 5.0时,上述平衡向___________(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是__________。
(3)在850℃时,若x="5.0" mol,其它物质的投料不变,当上述反应达到平衡后,求H2的体积分数(计算结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(16分)某小组同学利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,倒入大试管中迅速振荡混合均匀,再加入硫酸,开始计时,通过测定混合溶液褪色所需时间来判断反应的快慢(已知反应方程式为:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O)。该小组设计了如下方案。
| 编号 | H2C2O4溶液 | KMnO4溶液 | 硫酸溶液 | 温度/℃ | ||
| | 浓度 (mol/L) | 体积 (mL) | 浓度 (mol/L) | 体积 (mL) | | |
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 4mL 4mol/L | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 4mL 4mol/L | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 4mL 4mol/L | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气中O2的体积百分数。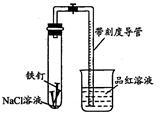
(1)实验前用碱液清洗铁钉,再用0.100mol/L的H2SO4溶液浸泡至有气泡产生。用H2SO4溶液浸泡的目的是_____ 。
(2)为尽量减小误差,下列操作的正确顺序是______ (填序号)。
①装人铁钉②插入注射器向铁钉表面滴入适量 NaCl溶液并打开止水夹③将导管口浸入品红溶液④塞 上单孔活塞⑤检查装置气密性
(3)实验中试管内发生的总反应为__ ____ ;用该实验方案测量空气中O2的体积百分数时应测量的数据是:①导管与试管内部空间总体积,②______ 。
(4) 实验时发现上述测量过程因反应较慢耗时较长,对其影响因素作如下分析,请补充 写出假设三:
假设一:电解质溶液的PH不同
假设二:NaCl溶液的浓度不同
假设三:
(5)借助上述实验装置,通过调节溶液的pH验证假设一,获得了如下实验数据:
①当pH=2时,没有观察到稳定液柱形成的原因是__ ____
②根据实验数据分析,为缩短实验测定时间,pH的最佳范围是______
③按上述实验装置,设计实验证明假设二。
第一步:___________ ;
第二步::相同温度下,加入系统表面积的铁钉,组装两套完全相同的上述装置,分别用注射器将NaCl溶液滴入铁钉表面;
第三步:记录形成稳定液柱所用时间和液柱的高度,比较分析数据得出结论。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com