
��ҵ������ʱ�����ô�������Ӧ��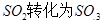 ��һ���ؼ��IJ��衣
��һ���ؼ��IJ��衣
��1��ij�¶��£�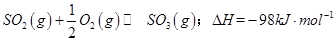 ����ʼʱ��100L���ܱ������м���4.0molSO2(g)��10.0molO2������Ӧ�ﵽƽ��ʱ���ų�����196kJ�����¶���ƽ�ⳣ��K=____________��
����ʼʱ��100L���ܱ������м���4.0molSO2(g)��10.0molO2������Ӧ�ﵽƽ��ʱ���ų�����196kJ�����¶���ƽ�ⳣ��K=____________��
��2��һ�������£���һ���������ܱ������г���2mol mol
mol ,������Ӧ:
,������Ӧ: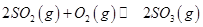 ,��ƽ���ı�����������
,��ƽ���ı�����������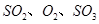 ����ƽ��Ũ�ȶ���ԭ���������____________(����ĸ)��
����ƽ��Ũ�ȶ���ԭ���������____________(����ĸ)��
A�������¶Ⱥ�����������䣬����2mol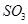 |
| B�������¶Ⱥ�����������䣬����2molN2 |
C�������¶Ⱥ�������ѹǿ���䣬����1mol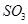 |
| D���ƶ�����ѹ������ |
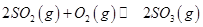 ��Ӧ��ͼ���У�����ȷ����_________��
��Ӧ��ͼ���У�����ȷ����_________��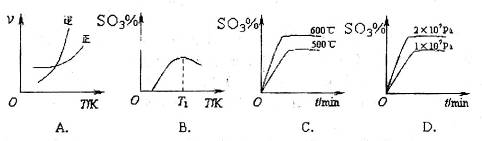
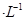 ��������Һ���������̹�ת����0.1mol����ʱ������������SO2�����Ϊ����״����Ϊ_________������Һ��pH="__________" (������Һ����仯)��
��������Һ���������̹�ת����0.1mol����ʱ������������SO2�����Ϊ����״����Ϊ_________������Һ��pH="__________" (������Һ����仯)�� ��ÿ��2�֣�
��1��10/3��3.33
��2��A��D
��3��C
��4��2SO2 �C 4e? + 4H2O = 2SO42? +8H+ 1.12L 1
�ķѴ����ĵ��ܣ������ã����ʵͣ����ܴ��ģ����
������������� ��1��ת����SO2Ϊ��196kJ��98kJ?mol?1=2mol,��������ʽ���㣺
SO2 +  O2
O2  SO3
SO3
��ʼŨ�ȣ�mol?L?1�� 0.04 0.1 0
ת��Ũ�ȣ�mol?L?1�� 0.02 0.01 0.02
ƽ��Ũ�ȣ�mol?L?1�� 0.02 0.09 0.02
�ɵ�ƽ�ⳣ��K=0.02�£�0.02��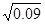 =10/3
=10/3
��2��A������SO3��ƽ�������ƶ�������Ũ�ȶ�����B��N2�뷴Ӧ�أ�����Ũ�ȶ����䣻C������ѹǿ���䣬����SO3�����ݵ�Чƽ��ԭ��������Ũ�Ȳ��䣻D����ѹ������ʵ�Ũ�ȶ�����ԭƽ�⣻E�������¶ȣ�ƽ�������ƶ���SO2��O2Ũ������SO3Ũ�ȼ�С��
��3��A���¶����ߣ�ƽ�������ƶ����淴Ӧ�������ӵı�������ȷ��B��ͼ���ǰ���Ϊ��Ӧ����ƽ��Ĺ��̣�SO3%������T1֮��Ľ�Ϊ��ѧ��Ӧ���¶ȵ�����ƽ���ƶ��Ĺ��̣������¶ȣ�ƽ�������ƶ�SO3%��С��ͼ����ȷ��C��600�����500�棬ƽ�������ƶ���SO3%��С��ͼ�����D������ѹǿ��ƽ�������ƶ���SO3%����ͼ����ȷ��
��4���������Ϸ���ʧ���ӷ�Ӧ��SO2ʧ��������SO42?��
��V(SO2) =0.1mol��2��22.4L/mol=1.12L��
pH=-lg��0.1mol��2��2L��=1
�۵����Ҫ���Ĵ����ĵ��ܣ����Ա���ƺķѴ����ĵ��ܣ������ã����ʵͣ����ܴ��ģ������
���㣺���⿼��ƽ�ⳣ���ļ��㡢��ѧƽ����ƶ�����ѧƽ���ͼ���ص缫����ʽ����д�����㡣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��18�֣�̼������������ѧ��ѧ��Ҫ�ķǽ���Ԫ�أ��ڹ�ũҵ�������й㷺��Ӧ�á�
��1�����ڷ��䡰�칬һ�š��ij�������F�����ȼ����Һ̬ƫ�����£�CH3��NH��NH��CH3������������Һ̬�����������������ڷ�Ӧ�����зų�����������ͬʱ������������Ⱦ�����塣��֪�����£�1 gȼ����ȫȼ���ͷų�������Ϊ42.5kJ����д���÷�Ӧ���Ȼ�ѧ����ʽ________________________________________��
��2��298 Kʱ����2L���ܱ������У��������淴Ӧ��2NO2(g) N2O4(g)����H��-a kJ��mol��1 (a>0) ��N2O4�����ʵ���Ũ����ʱ��仯��ͼ����ƽ��ʱ�� N2O4��Ũ��ΪNO2��2�����ش��������⡣
N2O4(g)����H��-a kJ��mol��1 (a>0) ��N2O4�����ʵ���Ũ����ʱ��仯��ͼ����ƽ��ʱ�� N2O4��Ũ��ΪNO2��2�����ش��������⡣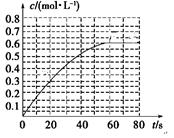
��298kʱ���÷�Ӧ��ƽ�ⳣ��Ϊ________ L ��mol��1��
��������ʵ���жϸ÷�Ӧ����ƽ��״̬����
a.���������ܶȱ��ֲ���
b.����������ɫ���ٱ仯
c. V��N2O4����=2V��NO2����
������Ӧ��398K���У�ijʱ�̲��n��NO2��="0.6" mol n��N2O4��=1.2mol�����ʱ
V������ V���棩���>����<����=������
��3��NH4HSO4�ڷ����Լ���ҽҩ�����ӹ�ҵ����;�㷺������100 mL 0.1 mol��L��1NH4HSO4��Һ�еμ�0.1 mol��L��1NaOH��Һ���õ�����ҺpH��NaOH��Һ����Ĺ�ϵ������ͼ��ʾ��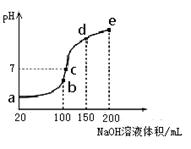
�Է���ͼ��a��b��c��d��e����㣬
��ˮ�ĵ���̶�������__________��
������Һ��c(OH-)����ֵ��ӽ�NH3��H2O�ĵ��볣
��K��ֵ���� ��
����c�㣬��Һ�и�����Ũ���ɴ�С������˳��
��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��7�֣���0.4 mol X�����0.6 mol Y��������2 L�ܱ������У�ʹ���Ƿ������·�Ӧ��4X(g)��5Y(g)��nZ(g)��6W(g)��2 minʱ����0.3 mol W����ʱ��֪��Z��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.05 mol��L��1��min��1���Լ��㣺
��1��ǰ2 min����X��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ mol��L��1��min��1��
��2������nֵ��2 minĩʱY��Ũ�ȣ�д����Ҫ�ļ�����̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
���ܱ������У���1.0molCO��1.0molH2O��ϼ��ȵ�800�棬�������з�Ӧ��
CO(g)+H2O(g) CO2(g)+H2(g)��һ��ʱ���÷�Ӧ�ﵽƽ�⣬���CO�����ʵ���Ϊ0.5mol����
CO2(g)+H2(g)��һ��ʱ���÷�Ӧ�ﵽƽ�⣬���CO�����ʵ���Ϊ0.5mol����
(1)�ﵽƽ��ʱCO2�����ʵ��������÷�Ӧ�Ļ�ѧƽ�ⳣ����
(2)�ﵽƽ������ƽ����ϵ��ͨ��1.0molˮ�������ﵽ�µ�ƽ��״̬ʱ����ˮ���������ʵ�����CO2�����ʵ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�״�����Ϊȼ�ϵ�ص�ԭ�ϡ���CH4��H2OΪԭ�ϣ�ͨ�����з�Ӧ���Ʊ��״���
I��CH4(g)+H2O(g) CO(g)+3H2(g) ��H=+206.0kJ?mol��1
CO(g)+3H2(g) ��H=+206.0kJ?mol��1
II��CO(g)+2H2(g) CH3OH(g) ��H=��129.0kJ?mol��1
CH3OH(g) ��H=��129.0kJ?mol��1
��1��CH4(g)��H2O(g)��Ӧ����CH3OH(g)��H2(g)���Ȼ�ѧ����ʽΪ ��
��2����1.0mol CH4��1.0mol H2O(g)ͨ���ݻ�Ϊ100 L�ķ�Ӧ�ң���һ�������·�����ӦI�������һ����ѹǿ��CH4��ת�������¶ȵĹ�ϵ��ͼ��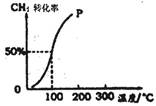
�ټ���100��ʱ�ﵽƽ�����蹹ʱ��Ϊ5min������H2��ʾ�÷�Ӧ��ƽ����Ӧ����Ϊ ��
��1000Cʱ��ӦI��ƽ�ⳣ��Ϊ ��
��3����ѹǿΪ0.1 MPa���¶�Ϊ300�������£���a molCO��2a mol H2�Ļ�������ڴ��������·�����ӦII���ɼ״���ƽ����������ݻ�ѹ����ԭ����1/2�������������䣬��ƽ����ϵ������Ӱ���� ������ĸ��ţ���
| A��ƽ�ⳣ��K���� | B������Ӧ���ʼӿ죬�淴Ӧ���ʼ��� |
| C��CH3OH�����ʵ������� | D������ƽ��c(H2)/c(CH3OH)��С |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��֪����KI�����ᡢ�Լ�X�͵���������Һ��ϣ���Ӧ���������ټ���˫��ˮ����������Ӧ��H2O2+2H++2I����2H2O+I2�������ɵ�I2�������Լ�X��Ӧ�������ġ�һ��ʱ����Լ�X������Ӧ���ɵ�I2��ȫ���ġ�������Һ�е�I��������H2O2���������ɵ�I2��������ã���Һ������������ˣ������Լ�X����������˫��ˮ����Һ���������ʱ�䣬�������㷴ӦH2O2+2H++2I����2H2O+I2�ķ�Ӧ���ʡ�
�±�Ϊijͬѧ��������ԭ����Ƶ�ʵ�鼰ʵ���¼����ʵ��������������½��У���
| ��� | ���ձ��м�����Լ�����������mL�� | ���� | ��ʼ����ʱ�䣨min�� | ||||
| 0.1 mol��L��1 KI��Һ | H2O | 0.01 mol��L��1 X��Һ | 0.1 mol��L��1 ˫��ˮ | 1 mol��L��1 ϡ���� | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | �� | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | �� | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | �� | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5��Fe2(SO4)3 | 0.6 |
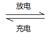 2AlI3��s������I�������л�����ϳ�����Ϊ����ʣ��õ�ظ����ĵ缫��ӦΪ��______________________________�����ʱAl���ӵ�Դ��___________����
2AlI3��s������I�������л�����ϳ�����Ϊ����ʣ��õ�ظ����ĵ缫��ӦΪ��______________________________�����ʱAl���ӵ�Դ��___________�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ��H=?867 kJ��mol��1���÷�Ӧ���������������������Ⱦ����130���180��ʱ���ֱ�0.50 molCH4��a molNO2����1L���ܱ������з�����Ӧ������й��������±���
N2(g)+CO2(g)+2H2O(g) ��H=?867 kJ��mol��1���÷�Ӧ���������������������Ⱦ����130���180��ʱ���ֱ�0.50 molCH4��a molNO2����1L���ܱ������з�����Ӧ������й��������±���
| ʵ���� | �¶� | ʱ�� | 0 | 10 | 20 | 40 | 50 |
| 1 | 130�� | n��CH4��/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180�� | n��CH4��/mol | 0.50 | 0.30 | 0.18 | | 0.15 |

 4NO(g)+CO2(g)+2H2O(g) ��H1=?574 kJ��mol��1
4NO(g)+CO2(g)+2H2O(g) ��H1=?574 kJ��mol��1 2N2(g)+CO2(g)+2H2O(g) ��H2
2N2(g)+CO2(g)+2H2O(g) ��H2�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
������H2O2�ڷ�Ӧʱ��������Ⱦ�����Ϊ��ɫ������������ܵ�����Խ��Խ��Ĺ�ע��
��.ijʵ��С����H2O2�ֽ�Ϊ����̽��Ũ�ȡ���������Һ����ԶԷ�Ӧ���ʵ�Ӱ�졣�ڳ����°����±���ʾ�ķ������ʵ�顣
| ʵ���� | ��Ӧ�� | ���� |
| �� | 10 mL 2%H2O2��Һ | �� |
| �� | 10 mL 5%H2O2��Һ | �� |
| �� | 10 mL 5%H2O2��Һ | 1 mL 0.1 mol��L��1FeCl3��Һ |
| �� | 10 mL 5%H2O2��Һ������HCl��Һ | 1 mL 0.1 mol��L��1FeCl3��Һ |
| �� | 10 mL 5%H2O2��Һ������NaOH��Һ | 1 mL 0.1 mol��L��1FeCl3��Һ |



�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����˵����ȷ����
A����25�洿ˮ������95��ʱ,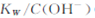 ���� ���� |
B����pH=11��Na2CO3��Һ��ˮϡ��, ���� ���� |
| C��������,pH=a��������pH=b�İ�ˮ�������Ϻ�pH=7,��a+b="14" |
| D��0��1mol��L-��HA��0��1mol��L-NaOH��Һ�������Ϻ�pH>7,�� |
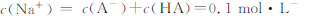
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com