
���ܱ������У���1.0molCO��1.0molH2O��ϼ��ȵ�800�棬�������з�Ӧ��
CO(g)+H2O(g) CO2(g)+H2(g)��һ��ʱ���÷�Ӧ�ﵽƽ�⣬���CO�����ʵ���Ϊ0.5mol����
CO2(g)+H2(g)��һ��ʱ���÷�Ӧ�ﵽƽ�⣬���CO�����ʵ���Ϊ0.5mol����
(1)�ﵽƽ��ʱCO2�����ʵ��������÷�Ӧ�Ļ�ѧƽ�ⳣ����
(2)�ﵽƽ������ƽ����ϵ��ͨ��1.0molˮ�������ﵽ�µ�ƽ��״̬ʱ����ˮ���������ʵ�����CO2�����ʵ���������
(1)25% 1
(2)1.33mol 22.22%
������������� CO(g) + H2O(g)  CO2(g) + H2(g)
CO2(g) + H2(g)
��ʼ���ʵ����� 1.0mol 1.0mol 0 0
ת���� x x x x
ƽ�����ʵ����� (1-x)mol (1-x)mol x x
�������֪�� x=0.5mol
�ﵽƽ��ʱCO2�����ʵ�������Ϊ��x/2=0.25=25%
�÷�Ӧ�Ļ�ѧƽ�ⳣ��: 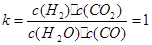
�� CO(g) + H2O(g)  CO2(g) + H2(g)
CO2(g) + H2(g)
ƽ��ʱ�����ʵ�Ũ�ȣ� 0.5mol 0.5mol 0.5mol 0.5mol
ͨ��1.0molˮ������ 0.5mol 1.5mol 0.5mol 0.5mol
ת���� y y y y
�ٴ�ƽ�⣺ ��0.5-y�� (1.5-y) (0.5+y) (0.5+y)
����ƽ�ⳣ���У�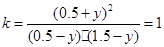
��֮�ã�
ˮ���������ʵ���:n(H2O)=1.5-0.5/3=4/3mol
CO2�����ʵ�������: 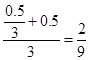
���㣺ƽ�ⳣ�����й�֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��13�֣���Щ�������������Ƶ�����ּ���������������̼�������������������ǵ��¼�����������Ҫ���أ��о���Щ��������ۺϴ���������Ҫ���塣
��1����ҵ�Ͽ����ö�����̼�Ͱ����ϳ����أ����ܷ�Ӧ���£�
2NH3(g)+CO2(g)  CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l) 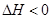 ���÷�Ӧ�� ����ϸ��¶ȡ��ϵ��¶ȡ��������Է����С�
���÷�Ӧ�� ����ϸ��¶ȡ��ϵ��¶ȡ��������Է����С�
��2����֪�ϳ����ط��������У�
��1����2NH3(g)+CO2(g) NH2COONH4(s)
NH2COONH4(s) 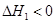
��2����NH2COONH4(s) CO(NH2)2(l)+ H2O(l)
CO(NH2)2(l)+ H2O(l) 
����ʾ��ͼ��[a��ʾ2NH3(g)+ CO2(g)��b��ʾNH2COONH4(S)��c��ʾCO(NH2)2(l)+ H2O(l)]������ȷ��ʾ���غϳɹ����������仯���ߵ��ǣ�����ţ� ��
��3���ϳ����ع����У���NH3��CO2�����ʵ���֮��Ϊ1:2ʱ��NH3
��ת������ʱ��ı仯��ϵ��ͼ��ʾ��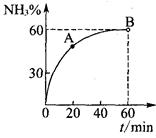
��A����淴Ӧ����v��(CO2) B����淴Ӧ����
v�� (CO2)(�������������=��)��
�ڴﵽƽ��ʱ��CO2��ת����Ϊ ��
��4������̿�����ڴ���������Ⱦ��NO����ij1L�����ܱ������м��� 0.100molNO ��2.030mol�������̿�������ʣ�����������E������F�����¶ȷֱ���T1���T2��ʱ�����ƽ��ʱ�����ʵ����ʵ������±���
 ���� ����n/mol T/�� | ����̿ | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
������N2H4��������������һ����Ҫ�Ļ��ȼ�ϡ�N2H4��N2O4��Ӧ�ܷų��������ȡ�
��1����֪��2NO2��g�� N2O4��g�� ��H=-57.20kJ��mol-1��һ���¶��£����ܱ������д˷�Ӧ�ﵽƽ�⡣ ������������ʱ�����д�ʩ����ʹNO2ת������ߵ���
N2O4��g�� ��H=-57.20kJ��mol-1��һ���¶��£����ܱ������д˷�Ӧ�ﵽƽ�⡣ ������������ʱ�����д�ʩ����ʹNO2ת������ߵ���
| A������NO2��Ũ�� | B�������¶� | C������NO2��Ũ�� | D�������¶� |
 N2O4��g����ƽ�ⳣ��K= ��
N2O4��g����ƽ�ⳣ��K= ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
������̶����ܱ�������N2��H2������Ӧ��N2��g����3 H2 2 NH3
2 NH3
�ﵽƽ��ʱc ��N2����3.5 mol��L-1��c ��H2����1 mol��L-1��c ��NH3����5 mol��L-1����
��1��N2��H2����ʼŨ�ȣ�4�֣�
��2��N2��ת���ʣ�2�֣���Ҫ���н�����̣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�ں���ʱ����ij�ܱ�������ͨ��2mol X��1mol Y���壬�������·�Ӧ��
2X(��)��Y(��)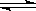 2Z(��)��ѹǿһ��ʱ�������ƽ��ʱZ���������Ϊ0.4��
2Z(��)��ѹǿһ��ʱ�������ƽ��ʱZ���������Ϊ0.4��
��1��������ƽ�Ᵽ��ͬ�¡�ͬѹ�������ܱ�������ͨ��4mol X(��)��2mol Y(��)���ﵽƽ�⣬��Z���������Ϊ ��ƽ��ʱ������������ʵ����� ��
��2�������ܱ�����ͨ��X��������Y�����������ʵ����ֱ��Ϊn��X����n��Y�������������ݻ����䣬������ƽ��ʱZ���������Ϊ0.4����n��X��/n��Y����ȡֵ��ΧΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��N2�� H2��һ��������ϣ�����ͬ״�������ܶ���H2�� 3��6����ȡ0��5mol�û������ͨ���ܱ������ڣ�ʹ֮������Ӧ����һ�������´ﵽƽ�⡣��֪��Ӧ�ﵽƽ���������ѹǿ����ͬ�����·�Ӧǰѹǿ��0��76��������
��1����Ӧǰ���������N2�� H2������ȣ�
��2���ﵽƽ��ʱ��������еİ������������
��3��ƽ��ʱN2��ת���ʡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��ҵ������ʱ�����ô�������Ӧ�� ��һ���ؼ��IJ��衣
��һ���ؼ��IJ��衣
��1��ij�¶��£�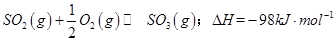 ����ʼʱ��100L���ܱ������м���4.0molSO2(g)��10.0molO2������Ӧ�ﵽƽ��ʱ���ų�����196kJ�����¶���ƽ�ⳣ��K=____________��
����ʼʱ��100L���ܱ������м���4.0molSO2(g)��10.0molO2������Ӧ�ﵽƽ��ʱ���ų�����196kJ�����¶���ƽ�ⳣ��K=____________��
��2��һ�������£���һ���������ܱ������г���2mol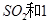 mol
mol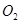 ,������Ӧ:
,������Ӧ: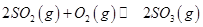 ,��ƽ���ı�����������
,��ƽ���ı�����������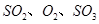 ����ƽ��Ũ�ȶ���ԭ���������____________(����ĸ)��
����ƽ��Ũ�ȶ���ԭ���������____________(����ĸ)��
A�������¶Ⱥ�����������䣬����2mol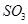 |
| B�������¶Ⱥ�����������䣬����2molN2 |
C�������¶Ⱥ�������ѹǿ���䣬����1mol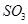 |
| D���ƶ�����ѹ������ |
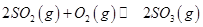 ��Ӧ��ͼ���У�����ȷ����_________��
��Ӧ��ͼ���У�����ȷ����_________��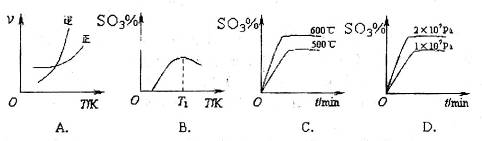
 ��������Һ���������̹�ת����0.1mol����ʱ������������SO2�����Ϊ����״����Ϊ_________������Һ��pH="__________" (������Һ����仯)��
��������Һ���������̹�ת����0.1mol����ʱ������������SO2�����Ϊ����״����Ϊ_________������Һ��pH="__________" (������Һ����仯)�� �鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
����������Ҫ�ɷ�ΪFeS2��Ϊԭ���Ʊ��Ȼ������壨FeCl3��6H2O���Ĺ����������£�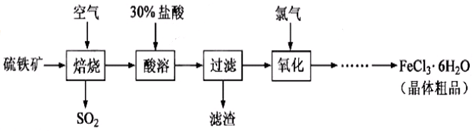
�ش��������⣺
��1����һ�������£�SO2ת��ΪSO3�ķ�ӦΪ2SO2(g)+O2(g) 2SO3(g) ���÷�Ӧ��ƽ�ⳣ������ʽΪK= ��������SO2��NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ
2SO3(g) ���÷�Ӧ��ƽ�ⳣ������ʽΪK= ��������SO2��NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ
��2�����ܼ����������о��豣�������������Ŀ���� �� ��
��3��ͨ����������ʱ����������Ҫ��Ӧ�����ӷ���ʽΪ ���ù��̲�����β�����ü���Һ���գ�β������Ⱦ����������Ϊ ��д��ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
���������(Na2S2O3)�׳ƴ��մ�����ҵ��������Ӱ����Na2S2O3������ˮ����������Һ�����ᷴӦ�е������SO2���ɡ�
��1��Na2S2O3��Һ��ϡ�����Ϸ�Ӧ������̽����������Է�Ӧ���ʵ�Ӱ�죬����йص�ʵ����Ʊ�(��֪����Һ�����Ϊ5 mL)��
| ʵ���� | T/K | c(Na2S2O3)/ mol��L��1 | c(H2SO4)/ mol��L��1 | ʵ��Ŀ�� |
| �� | 298 | 0.1 | 0.1 | ʵ��ٺ͢�̽���¶ȶԸ÷�Ӧ���ʵ�Ӱ�죻ʵ��١��ۺ͢�̽����Ӧ��Ũ�ȶԸ÷�Ӧ���ʵ�Ӱ�� |
| �� | 308 | | | |
| �� | | 0.2 | | |
| �� | | 0.1 | |
| ʵ�鲽�� | Ԥ������ͽ��� |
| ����1��ȡ�����������Թ��У�������ˮ�ܽ� | |
| ����2�� | |
| ����3�� | |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com