
【题目】下列说法不正确的是
A. 环戊二烯(![]() )分子中所有碳原子共平面
)分子中所有碳原子共平面
B. 正丁烷与异丁烷互为同分异构体的依据是它们的分子式相同,但分子内碳原子的连接方式不同
C. 七叶内酯(![]() )和东莨菪内酯(
)和东莨菪内酯(![]() )都是某些中草药中的成分,它们具有相同的官能团,互为同系物
)都是某些中草药中的成分,它们具有相同的官能团,互为同系物
D. 有机物(![]() )不能与氢氧化钠发生中和反应,但能发生取代反应
)不能与氢氧化钠发生中和反应,但能发生取代反应
科目:高中化学 来源: 题型:
【题目】某学习小组同学为探究同周期或同主族元素性质的递变规律,设计了如下系列实验:
利用下图装置来验证同主族元素非金属性的变化规律:
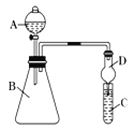
(1)要证明非金属性:Cl>I,在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液________________的现象,即可证明。干燥管D的作用是___________________。从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用___________溶液吸收尾气。
(2)要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,将观察到C中______________的现象。但老师认为,该现象不足以证明酸性强弱关系为碳酸>硅酸,请用文字叙述理由_______________________________。
因此应在B、D之间增加一个盛有足量____(选填下列字母:A.浓盐酸 B.浓NaOH溶液C.饱和Na2CO3溶液 D.饱和NaHCO3溶液)的洗气装置。
改进后C中发生反应的化学方程式是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源与材料、信息被称为现代社会发展的三大支柱,化学与能源有着密切联系。
(1)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1):
化学键 | H—H | Cl-Cl | H—Cl |
键能 | 436 | 243 | 431 |
请根据以上信息写出氢气在氯气中燃烧生成氯化氢气体的热化学方程式_______。
(2)天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
①以甲烷、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式为___________________________。
②将质量相等的铁棒和石墨棒分别插入CuCl2溶液中,铁棒接甲烷燃料电池负极,石墨棒接该电池正极,一段时间后测得铁棒比石墨棒增加了6.4克。写出铁棒电极上发生的电极反应式________; 则理论上消耗CH4的体积在标准状况下为_____。
(3)如图所示的实验装置中,丙为用碘化钾溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹;丁为直流电源,x、y为电源的两极;G为电流计;A、B、C、D四个电极均为石墨电极。若在两试管中充满H2SO4溶液后倒立于H2SO4溶液的水槽中,闭合K2,断开K1。

①丙电解时反应的离子方程式为______________。
②继续电解一段时间后,甲池中A、B极均部分被气体包围,此时断开K2,闭合K1,电流计G指针发生偏转,则B极的电极反应式为__________________,C极的电极反应为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁屑和铜屑一起放入稀HNO3中,有少量铜屑剩余,则溶液中可能有的金属离子是( )
A.Fe3+和Cu2+
B.Fe2+和Cu2+
C.Fe2+和Fe3+
D.只有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示与对应叙述相符的是

A. 图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)>Ksp(CuS)
B. 图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C. 图丙表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
D. 图丁表示反应N2(g)+3H2(g) ![]() 2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中常见的金属防腐的方法很多.下列措施不能起到防腐的是
A. 地下钢铁管道用导线连接着铜块 B. 衣架和电线的外面包上一层塑料层
C. 在轮船船身上装上一定数量的锌块 D. 铁制健身器材刷油漆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有硫酸和盐酸的混合溶液20mL,在该溶液中滴入0.05mol/L的Ba(OH)2溶液时,生成BaSO4的质量和溶液的pH得到如图所示的结果,求:

⑴最初混合液中硫酸的物质的量浓度____________________
盐酸的物质的量浓度____________________
⑵在A点溶液的pH=____________________。
Ⅱ.Ba2+是一种重金属离子,对生物体有害,环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度。
(1)现需配制250mL0.100mol·L—1标准Na2S2O3溶液,所需要的玻璃仪器除量筒、250mL容量瓶、玻璃棒外,还需要_____________________。
(2)需准确称取Na2S2O3固体的质量为________________g。
(3)另取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液反应,反应液中再滴加上述Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。
已知有关的离子方程式为:
①Cr2O72-+6I-+14H+ 2Cr3++3I2+7H2O;
②I2+2S2O32- 2I-+S4O62-.试计算该工厂废水中Ba2+的物质的量浓度c(Ba2+)=________________________。
Ⅲ.试回答下列问题:
(1)已知24 g A和40 g B恰好完全反应生成0.4 mol C和32 g D,则C的摩尔质量为_________________。
(2)把1 mol Na和1 mol Mg分别投入到等量且过量的盐酸中,分别得到溶液a和b,则溶液a和b的质量关系为ma_____________mb。
(3)如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19 g·cm-3
HCl的质量分数:36.5%
①该浓盐酸中HCl的物质的量浓度为____________mol·L-1。
②标准状况下,1.00 L水(密度为1.00 g·cm-3)吸收_____________L的HCl可制得上述浓盐酸(保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是( )
A. SO2、SiO2、NO均为酸性氧化物
B. 稀豆浆、牛奶、氯化铁溶液均为胶体
C. 烧碱、乙醇、四氯化碳均为电解质
D. 福尔马林、水玻璃、氨水均为混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com