
【题目】Ⅰ.现有硫酸和盐酸的混合溶液20mL,在该溶液中滴入0.05mol/L的Ba(OH)2溶液时,生成BaSO4的质量和溶液的pH得到如图所示的结果,求:

⑴最初混合液中硫酸的物质的量浓度____________________
盐酸的物质的量浓度____________________
⑵在A点溶液的pH=____________________。
Ⅱ.Ba2+是一种重金属离子,对生物体有害,环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度。
(1)现需配制250mL0.100mol·L—1标准Na2S2O3溶液,所需要的玻璃仪器除量筒、250mL容量瓶、玻璃棒外,还需要_____________________。
(2)需准确称取Na2S2O3固体的质量为________________g。
(3)另取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液反应,反应液中再滴加上述Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。
已知有关的离子方程式为:
①Cr2O72-+6I-+14H+ 2Cr3++3I2+7H2O;
②I2+2S2O32- 2I-+S4O62-.试计算该工厂废水中Ba2+的物质的量浓度c(Ba2+)=________________________。
Ⅲ.试回答下列问题:
(1)已知24 g A和40 g B恰好完全反应生成0.4 mol C和32 g D,则C的摩尔质量为_________________。
(2)把1 mol Na和1 mol Mg分别投入到等量且过量的盐酸中,分别得到溶液a和b,则溶液a和b的质量关系为ma_____________mb。
(3)如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19 g·cm-3
HCl的质量分数:36.5%
①该浓盐酸中HCl的物质的量浓度为____________mol·L-1。
②标准状况下,1.00 L水(密度为1.00 g·cm-3)吸收_____________L的HCl可制得上述浓盐酸(保留整数)。
【答案】 0.05mol/L 0.2mol/L 1_ 烧杯、胶头滴管 3.95 0.024mol·L-1 80 g/mol = 11.9 353
【解析】本题考查化学计算和一定物质的量浓度溶液的配、物质的量浓度的计算、摩尔质量的计算,I.(1)当加入20mLBa(OH)2溶液时,沉淀达到最大,即SO42-全部转成沉淀,因此有n(H2SO4)=n(BaSO4)=n[(Ba(OH)2]=20×10-3×0.05mol=1×10-3mol,硫酸的浓度为c(H2SO4)=1×10-3/20×10-3mol·L-1=0.05mol·L-1;(2)当加入60mLBa(OH)2溶液,溶液的pH=7,说明H+和OH-恰好完全反应,即有60×10-3×0.05×2=20×10-3×0.05×2+n(HCl),解得n(HCl)=4×10-3mol,则c(HCl)=4×10-3/20×10-3mol·L-1=0.2mol·L-1;(2)A点沉淀达到最大,盐酸未反应,因此溶液中c(H+)=20×10-3×0.2/40×10-3mol·L-1=0.1mol·L-1,根据pH=-lgc(H+)=1;II.(1)配制一定物质的量浓度的溶液需要的仪器是量筒、容量瓶、玻璃棒、烧杯、胶头滴管,因此缺少的仪器是烧杯和胶头滴管;(2)需要Na2S2O3的质量为250×10-3×0.1×158g=3.95g;(3)根据反应:Ba2++CrO42-=BaCrO4↓,加入适量盐酸,发生反应:2CrO42-+2H+=Cr2O72-+H2O,再根据信息,建立关系式为2Ba2+~2CrO42-~Cr2O72-~3I2~6S2O32-,因此n(Ba2+)=36×10-3×0.1×2/6mol=1.2×10-3mol,则c(Ba2+)=1.2×10-3/50×10-3mol·L-1=0.024mol·L-1;III.(1)根据质量守恒,C的质量为(24+40-32)g=32g,根据M=m/n=32/0.4g·mol-1=80g·mol-1;(2)金属钠投入到盐酸中,发生2Na+2HCl=2NaCl+H2↑,产生m(NaCl)=1×58.5g=58.5g,产生氢气的质量为1×2/2g=1g,溶液的质量为 [(23+m(HCl)-1]g,金属镁加入到足量的盐酸中,发生Mg+2HCl=MgCl2+H2↑,产生m(MgCl2)=1×95g=95g,溶液质量为 [24+n(HCl)-2]g,即ma=mb;(3)①根据c=1000ρw%/M=1000×1.19×36.5%/36.5mol·L-1=11.9mol·L-1;②溶液的质量为[1×1000×1+36.5n(HCl)]g,溶质的质量为36.5n(HCl)g,因此有36.5n(HCl)/ [1×1000×1+36.5n(HCl)]×100%=36.5%,解得n(HCl)=15.7mol,其体积为15.7×22.4L=353L。


科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法正确的是( )
A. 氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色
B. C2H6O2与C3H6O2一定属于同系物
C. 苯可以与溴水、高锰酸钾溶液反应而使它们褪色
D. CH3CH218OH和CH3COOH反应生成的水的相对分子质量为18
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 环戊二烯(![]() )分子中所有碳原子共平面
)分子中所有碳原子共平面
B. 正丁烷与异丁烷互为同分异构体的依据是它们的分子式相同,但分子内碳原子的连接方式不同
C. 七叶内酯(![]() )和东莨菪内酯(
)和东莨菪内酯(![]() )都是某些中草药中的成分,它们具有相同的官能团,互为同系物
)都是某些中草药中的成分,它们具有相同的官能团,互为同系物
D. 有机物(![]() )不能与氢氧化钠发生中和反应,但能发生取代反应
)不能与氢氧化钠发生中和反应,但能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解精炼铜的阳极泥主要成分为Cu2Te、Ag2Se和少量金属单质及其他化合物,工业上从其中回收碲、硒的一种工艺流程如下:
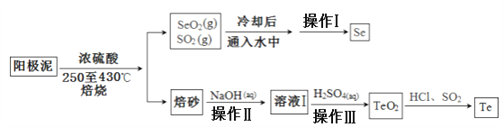
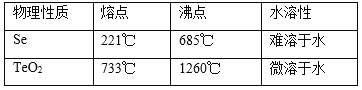
已知TeO2与Al2O3的化学性质相似,元素碲在溶液中主要以Te4+、TeO32-等形式存在;Se和TeO2的物理性质如下:
(1)加入浓硫酸焙烧前常将阳极泥中大块颗粒先粉碎其目的是______________________。
(2)上述流程中操作仅为物理分离过程,其名称为___________,SeO2与SO2在冷水中反应的化学方程式___________________________。
(3)焙砂中碲以TeO2形式存在,写出氢氧化钠溶液与TeO2反应的离子方程式___________。
(4)向溶液Ⅰ中加入硫酸时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4过量,将导致碲的回收率_____________(填“偏高”、“偏低”或“无影响”)。
(5)将纯净的TeO2先溶于盐酸得到四氯化碲,然后再通入二氧化硫得到碲单质,该过程中涉及到的反应类型有___________________________。
(6)上述流程中可循环利用的物质________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一化学反应,反应物和生成物都是气体,改变下列条件一定能使化学平衡向正反应方向移动的是( )
A.增大反应物浓度 B.减小反应容器的体积
C.增大生成物浓度 D.升高反应温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非索非那定(E)可用于减轻季节性过敏鼻炎引起的症状。其合成路线如下
(其中R-为 )
)

(1) E中的含氧官能团名称为___________和___________。
(2) X的分子式为C14Hl5ON,则X的结构简式为___________。
(3) B→C的反应类型为____________________。
(4) 一定条件下,A可转化为F( )。写出同时满足下列条件的F的一种同分异构体的结构简式:_________。
)。写出同时满足下列条件的F的一种同分异构体的结构简式:_________。
①能与FeCl3溶液发生显色反应;②能使溴水褪色;③有3种不同化学环境的氢
(5)已知:![]() 。化合物G(
。化合物G( )是制备非索非那定的一种中间体。请以
)是制备非索非那定的一种中间体。请以![]() 为原料制备G,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______
为原料制备G,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是

A. 两烧杯中铜片表面均无气泡产生
B. 甲中铜片是正极,乙中铜片是负极
C. 两烧杯中溶液的pH均增大
D. 甲、乙溶液均变蓝色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com