
 节能减排与我们的生活息息相关,参与节能减排是每一位公民应尽的义务.下列举措不符合这一要求的是( )
节能减排与我们的生活息息相关,参与节能减排是每一位公民应尽的义务.下列举措不符合这一要求的是( )| A. | 倡导开私家车的人乘公交车上下班 | |
| B. | 用节能灯代替白炽灯 | |
| C. | 政府鼓励科研和生产部门开发、利用太阳能 | |
| D. | 加快开发石油以缓解能源紧张问题 |
分析 节能减排就是工业上减少化石燃料的燃烧,淘汰高耗能产业,研制新的能源,减少二氧化碳气体的排放;生活中节约各种能源,垃圾分类处理等.
解答 解:A.乘公交车能降低人均耗能量,符合节能减排的做法,故A正确;
B.用节能灯代替白炽灯,消耗相同电力的条件下,节能灯的发光效率比白炽灯更高,能节能,间接减少污染气体排放,故B正确;
C.开发利用太阳能是寻找新型能源,符合节能减排的做法,故C正确;
D.石油越开采越少,不符合节能减排的做法,应合理开采,故D错误;
故选D.
点评 本题考查节能减排,把握减少能源使用、减少污染物的排放为解答本题的关键,注重化学与生活、环境的联系,注意能源应开源节流,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 晶体根据结构和性质只可分为分子晶体,原子晶体,离子晶体和金属晶体四大类 | |
| B. | 含有阳离子的晶体一定是离子晶体,且离子晶体中可能含有共价键 | |
| C. | 任何晶体中部分含有化学键,如离子键、共价键、金属键、氢键等 | |
| D. | 原子晶体的熔沸点不一定高于离子晶体,而离子晶体的熔沸点肯定高于分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
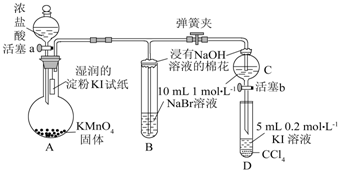
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N | B. | S | C. | Al | D. | O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F六种物质的相互转化关系如附图所示(反应条件未标出).
A、B、C、D、E、F六种物质的相互转化关系如附图所示(反应条件未标出).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.
 ;吡啶与混酸(浓硝酸与浓硫酸混合物)在加热条件下,发生硝化反应生成氮原子间位的一取代物的化学方程式为
;吡啶与混酸(浓硝酸与浓硫酸混合物)在加热条件下,发生硝化反应生成氮原子间位的一取代物的化学方程式为 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com