
下列关于原子结构、元素性质的说法正确的是 ( )
| A.ⅠA族金属元素是同周期中金属性最强的元素 |
| B.非金属元素组成的化合物中只含共价键 |
| C.同种元素的原子均有相同的质子数和中子数 |
| D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:单选题
在陆地生态系统研究中,2H、13C、15N、18O、34S等常用作环境分析指示物。下列说法正确的是
A.34S原子核内中子数为16 B.16O2比18O2沸点更低
C.2H+的酸性比1H+的酸性更强D.13C和15N原子核内的质子数相差2
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
甲、乙、丙、丁为4种短周期元素,在周期表中,甲与乙、丙、丁在周期表中的位置关系如右图所示(原子序数:乙>丙)。丁的原子序数与乙、丙原子序数之和相等,4种元素原子的最外层电子数之和为24。下列判断正确的是
| | 甲 | |
| | | |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
230Th和232Th是90号元素钍的两种同位素,232Th可以转化成233U。下列有关Th的说法正确的是
| A.230Th的中子数比核外电子数多140 |
| B.230Th和232Th的化学性质相同 |
| C.232Th 转换成233U是化学变化 |
| D.Th 元素的相对原子质量是231 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各原子或离子的电子排布式错误的是
| A.K+ 1s22s22p63s23p6 | B.F 1s22s22p5 |
| C.S2- 1s22s22p63s23p4 | D.Ar 1s22s22p63s23p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,X、Z的最外层电子数之和与Y、W的最外层电子数之和相等。甲的化学式为YX3,是一种刺激性气味的气体,乙的化学式为YZ3,丙是由X、Y、Z组成的盐。下列说法正确的是
| A.原子半径:W>Y>Z,而离子半径:Z>Y>W |
| B.X的单质分子中存在s-pσ键 |
| C.测得丙的水溶液呈酸性,则溶液中丙盐阳离子浓度大于酸根离子浓度 |
| D.Y的单质分子中有一个p-pσ键和二个p-pπ键 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示。若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )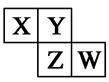
| A.X的最常见气态氢化物的水溶液显酸性 |
| B.最高价氧化物对应水化物的酸性W比Z强 |
| C.Z的单质与氢气反应较W剧烈 |
| D.X的原子半径小于Y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com