
【题目】电子式的运用
(1)用电子式表示粒子:
①氢氧根离子________;②羟基________;③二氧化碳分子_________。
(2)用电子式表示化合物的形成过程
④MgF2___________________________;⑤H2O _________________________。
 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下反应:2KNO3+3C+S=K2S+N2↑+3CO2↑。其中被氧化的元素是____________,还原产物是____________。
(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为4CuI+Hg=Cu2HgI4+2Cu。
①上述反应产物Cu2HgI4中,Cu元素显________价。
②以上反应中的氧化剂为________,当有1 mol CuI参与反应时,转移电子________mol。
③标明上述反应电子转移的方向和数目。____________________________。
(3)工业上常用酸性高锰酸钾溶液处理含有CuS和Cu2S的矿物,其反应原理如下:
8MnO4—+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4—+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
根据上述反应原理,某学习小组用400 mL 0.075 mol·L-1的酸性高锰酸钾溶液处理2 g含有CuS和Cu2S的混合物。反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1的(NH4)2Fe(SO4)2溶液完全反应。
①配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:______,MnO![]() +Fe2++H+=Mn2++Fe3++H2O
+Fe2++H+=Mn2++Fe3++H2O
②KMnO4溶液与固体混合物反应后,剩余KMnO4的物质的量为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有科学家正在研究用碳与一氧化氮反应处理环境问题
C(s)+2NO(g)![]() CO2(g)+N2(g)△H
CO2(g)+N2(g)△H
(1)实验方案中有下列措施:①采用加热提高反应速率,②使用催化剂提高反应速率,③使用加压提高NO转化率,④使CO2转化成干冰从体系用脱离,提高NO的转化率,你认为可行的是_________。
(2)这个反应的平衡常数表达式是_________________;
(3)在恒容恒温密闭容器中,科学家得到下列实验数据
时间(min) | 浓度(mol/L) | ||
NO | N2 | CO2 | |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
反应在该温度下的平衡常数K=_________________;
(4)若在(3)的实验中30min时开始升温,36min时达平衡,测得NO的转化率变为50%,则该反应的△H_______0(填“>”、“<”、“=”),判断的理由是___________________;
(5)若科学家在30min后改变了某一条件,反应进行到40min时达平衡浓度分别为c(NO)=0.032mol/L,c(N2)=0.034mol/L,c(CO2)=0.017mol/L,则改变的条件可能是______,判断的依据是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃的混和物共0.1mol,完全燃烧后得3.36L(标况下)CO2和3.6g水,下列说法正确的是( )
A. 一定有乙烯B. 一定有甲烷
C. 可能有乙烷D. 一定有乙烷,但不一定有甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种常见的绿色氧化剂,可由臭氧发生器(原理如图)电解稀硫酸制得。下列说法错误的是
是一种常见的绿色氧化剂,可由臭氧发生器(原理如图)电解稀硫酸制得。下列说法错误的是
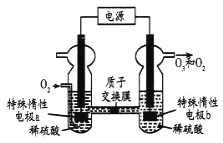
A. 电极a为阴极
B. 标准状况下,当![]() 反应时收集到
反应时收集到![]() 和
和![]() 混合气体
混合气体![]() ,
,![]() 的体积分数为80%
的体积分数为80%
C. 电解一段时间后b极周围的![]() 下降
下降
D. a极的电极反应为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知液氨的性质与水相似。T℃时,NH3+NH3![]() NH4++NH2-,NH4+的平衡浓度为1×10-15mol/L,则下列说法中正确的是( )
NH4++NH2-,NH4+的平衡浓度为1×10-15mol/L,则下列说法中正确的是( )
A. 在此温度下液氨的离子积为1×10-17
B. 在液氨中放入金属钠,可生成NaNH2
C. 恒温下,在液氨中加入NH4Cl,可使液氨的离子积减小
D. 降温,可使液氨电离平衡逆向移动,且c(NH4+)<c(NH2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖尿病是由于人体内胰岛素紊乱导致的代谢紊乱综合征,以高血糖为主要标志。长期摄入高热量食品或缺少运动,都会导致糖尿病。
(1)血糖是指血液中的葡萄糖,下列有关说法正确的是______________。
A.葡萄糖分子可表示为C6(H2O)6,则每个葡萄糖分子含有6个H2O分子
B.葡萄糖与果糖互为同分异构体
C.糖尿病人尿糖较高,可用新制的氢氧化铜来检测人尿液中的葡萄糖
D.淀粉水解的最终产物是氨基酸
(2)糖尿病人不可过量饮酒,将会一定程度上造成胰岛细胞损伤。但酒精在肝脏内可转化成有机物A。A的实验结果如下:
①通过实验测得A的相对分子质量为60;
②A由C、H、O三种元素组成,分子中只存在两种类型的氢原子,且这两种类型的氢原子个数比为1∶3
③A可与酒精在一定条件下生成有芳香气味的物质。
纯净的A又称为______________,结构简式为____________________。
A的主要化学性质有(用化学方程式表示):a____________________________________,
b___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于共价键的说法正确的是( )
A.丙炔分子中含有5个σ键和2个π键
B.乙醇分子中O-H键的极性强于C-H键的极性
C.乙烷分子中只含有极性键不含有非极性键
D.分子晶体中共价键键能越大,该分子晶体的熔点和沸点一定也越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,HNO3既表现出氧化性,又表现出酸性的是
A. 3Cu+8HNO3(稀) =3Cu(NO3)2+2NO↑+4H2O↑
B. CuO+2HNO3=Cu(NO3)2+H2O
C. 4HNO3(浓) ![]() 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
D. H2S+2HNO3(浓) ![]() S↓+2NO2+2H2O
S↓+2NO2+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com