
【题目】在下列溶液中,各组离子一定能够大量共存的是( )
A.无色溶液中:Na+、Cl、SO42﹣、Cu2+
B.使紫色石蕊溶液变红的溶液中:Na+、Ca2+、C032﹣、Cl﹣
C.含SO42﹣的溶液中:K+、Ba2+、CI﹣、Br﹣
D.酸性溶液中:Na+、S042﹣、Cl﹣、NH4+
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种元素,他们性质如下:
A | 周期表中原子半径最小的元素 |
B | 电负性最大的元素 |
C | C的2p轨道中有三个未成对的单电子 |
D | 原子核外电子数是B与C核外电子数之和 |
E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答如下问题:
(1)基态E原子有_____个未成对电子,二价E离子的核外电子排布式为_______。
(2)A2D分子中D原子的杂化类型是______,D的氧化物DO3分子空间构型为_______。
(3)CA3极易溶于水,其原因主要是_____,试判断CA3溶于水后,形成CA3· H2O的合理结构:____ (填字母代号), 推理依据是_____。

(4)在ESO4溶液中滴入过量氨水,形成配合物的颜色为______,反应的离子方程式为_____。
(5)ZnD的晶胞结构如图1所示,在ZnD晶胞中,D2-的配位数为______。
(6)E与金形成的金属互化物结构如图2所示,其晶胞边长为a nm,该金属互化物的密度为______(用含a、NA的代数式表示)g· cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCN(氰化钠)是一种重要的基础化工原料,可用于电镀、冶金和有机合成等。回答下列问题。
(1)NaCN溶液中发生水解反应的离子方程式为_______________________________,实验室配制NaCN溶液的方法是______________________________。
(2)NaCN与Cl2反应可制备ClCN(氯氰),氯氰的电子式为_________。
(3)制备NaCN的方法很多种。
①氨钠法:反应原理为2Na+2C+2NH3![]() 2NaCN+3H2。该反应中,每生成1molNaCN,转移电子的物质的量为_________。
2NaCN+3H2。该反应中,每生成1molNaCN,转移电子的物质的量为_________。
②NaCN也可由HCN 与NaOH反应制得。
已知:CH4(g)=C(s)+2H2(g) △H1;
2HCN(g)=2C(s)+H2(g)+N2(g) △H2;
N2(g)+3H2(g)![]() 2NH3(g) △H3。
2NH3(g) △H3。
则反应:CH4(g)+NH3(g)![]() HCN(g)+3H2(g)的△H=____________(用含△H1、△H2、△H3的代数式表示)。
HCN(g)+3H2(g)的△H=____________(用含△H1、△H2、△H3的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极c、d表面镀一层细小的铂粉,吸附气体的能力强,性质稳定,请回答:
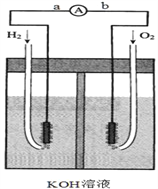
(1)氢氧燃料电池的能量转化主要形式是______。
(2)负极反应式为______.
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能,因此,大量安全储氢是关键技术之一,金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
I.2Li+H2 = 2LiH II. LiH +H2O = LiOH + H2↑
①反应I中的还原剂是______,反应II中的氧化剂是______
②已知LiH固体密度为0.82g/cm3,用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为______。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一束强光照射Fe(OH)3是胶体,我们在于光线垂直的方向可以看到一条光的通路,胶体的这种特性,叫做______,在该分散系中,分散质微粒的直径大约在______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校课外小组的同学设计实验用甲烷还原二氧化硫制取单质硫。
(1)甲组同学分别利用如图所示装置制取SO2 和CH4。
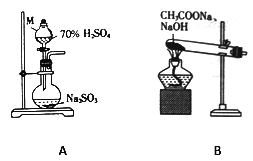
①仪器M的名称为______________。
②用A装置制备SO2,不宜使用稀硫酸,其原因是_________________。
③用B装置制取甲烷的化学方程式为CH3COONa+NaOH![]() CH4↑+Na2CO3,实际实验中常用碱石灰(NaOH 和CaO的混合物)来代替NaOH,原因是____________________________________。
CH4↑+Na2CO3,实际实验中常用碱石灰(NaOH 和CaO的混合物)来代替NaOH,原因是____________________________________。
(2)乙组同学利用甲组制得的CH4和SO2进行实验,并验证产物中除单质硫外还含有CO2。为进行验证,选用甲组实验中的装置A、B和下图所示的装置进行实验,发现G中有淡黄色固体生成,C中澄清石灰水变浑浊。
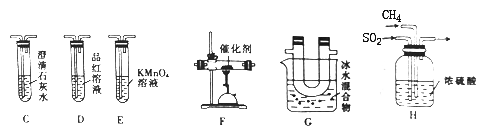
①乙组同学的实验装置中,依次连接的合理顺序为A、B→H→_____→ → → → 。
②E装置的作用是________________,G装置的作用是_______________。
③F装置中发生反应的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa时,1g甲醇完全燃烧生成CO2和液态水,同时放出22.68kJ热量,下列表示该反应的热化学方程式的是( )
A. CH3OH(l)+![]() O2===CO2(g)+2H2O(l) △H =-725.8kJ/mol
O2===CO2(g)+2H2O(l) △H =-725.8kJ/mol
B. 2CH3OH(l)+3O2(g)====2CO2(g)+4H2O(l) △H =+145.6kJ/mol
C. 2CH2OH(l)+3O2(g)====2CO2(g)+4H2O(l) △H =-22.68kJ/mol
D. CH3OH(l) +![]() O2(g)===CO2(g)+2H2O(g) △H =-725.8kJ/mol
O2(g)===CO2(g)+2H2O(g) △H =-725.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,对社会发展与进步作出了巨大贡献。
(1)450℃时,在一个体积为2L的恒容密闭容器中充入0.4 mol N2和0.6 mol H2(10min时改变某一条件),测得反应过程中N2、H2和NH3的物质的量随时间变化如下表:
时间 物质的量 | 5 min | 10 min | 15 min | 20 min | 25 min |
n(N2)/mol | 0.36 | 0.35 | 0.275 | 0.25 | 0.25 |
n(H2)/mol | 0.48 | 0.45 | 0.225 | 0.15 | 0.15 |
n(NH3)/mol | 0.08 | 0.1 | 0.25 | 0.30 | 0.30 |
①5~10 min内,生成NH3的平均反应速率是_______ mol/(L·min)。
②下列能作为判断该反应达到化学平衡状态的依据是_______(填字母序号)。
A.v(N2)正=3v(H2)逆 B.容器内压强保持不变
C.容器内混合气体的密度保持不变 D.容器内混合气体的平均相对分子量不变
③第10 min时改变的条件是使用了高效催化剂,理由是_______。
(2)合成氨的反应原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH。
2NH3(g) ΔH。
相关化学键键能数据如下:
化学键 | H—H | N≡N | N—H |
E /(kJ/mol) | 436 | 946 | 391 |
由此计算ΔH=_______kJ/mol,低温下,合成氨反应_______(填“能”或“不能”)自发进行。已知合成氨反应N2(g)+3H2(g)![]() 2NH3(g)的活化能Ea1=499kJ/mol,由此计算氨分解反应2NH3(g)
2NH3(g)的活化能Ea1=499kJ/mol,由此计算氨分解反应2NH3(g)![]() N2(g)+3H2(g)的活化能Ea2=_______kJ/mol。
N2(g)+3H2(g)的活化能Ea2=_______kJ/mol。
(3)已知:氨在某催化剂催化氧化过程中主要有以下两个竞争反应:
反应Ⅰ:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H =﹣906kJ/mol
4NO(g)+6H2O(g) △H =﹣906kJ/mol
反应II:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H =﹣1267kJ/mol
2N2(g)+6H2O(g) △H =﹣1267kJ/mol
①该条件下,N2(g)+O2(g)![]() 2NO(g) △H = _______kJ/mol
2NO(g) △H = _______kJ/mol
②为分析催化剂对反应的选择性,在1 L密闭容器中充入1 mol NH3和2 mol O2,测得有关物质的物质的量随温度变化如图所示。

该催化剂在较低温度时主要选择反应_______(填“反应Ⅰ”或“反应II”)。520℃时,反应Ⅰ的平衡常数K=_______(只列算式不计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:

据此判断:
(1)固体B所含物质的化学式为___________________________________________。
(2)固体E所含物质的化学式为__________________________________。
(3)反应①的离子方程式为________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com