
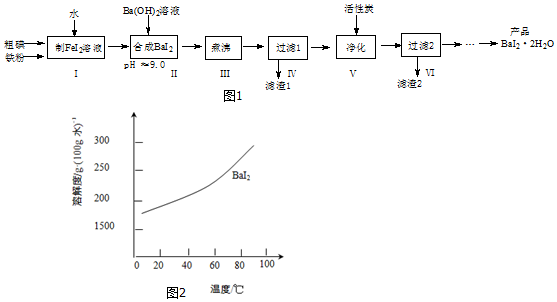
分析 碘、铁粉与水混合反应生成FeI2溶液,然后加入氢氧化钡调节pH值为9.0发生反应生成BaI2溶液和Fe(OH)2沉淀,煮沸过滤除去Fe(OH)2沉淀同时滤液为BaI2溶液,再在滤液中加入活性炭吸附残留的Fe(OH)2及有机杂质等,再过滤,最后将BaI2溶液通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到BaI2•2H2O,据此分析解答;
(1)搅拌、升温、增大反应物浓度、增大固体的接触面积等,可提高反应速率;
(2)步骤ⅡFeI2溶液加入氢氧化钡调节pH值为9.0发生反应生成BaI2溶液和Fe(OH)2沉淀;用pH试纸测定溶液pH的方法是把一小块pH试纸放在表面皿上,用玻璃棒蘸取待测溶液点在试纸的中部,试纸变色后,立刻与标准比色卡比较确定溶液的pH;
(3)使Fe(OH)2颗粒长大便于(步骤Ⅳ)过滤分离;根据活性炭具有吸附性分析作用;
(4)根据BaI2的溶解度随温度变化比较大分析析出晶体的方法.
解答 解:(1)a.铁粉和碘粉用球磨机磨成细粉,增大固体的接触面积,可提高反应速率,故正确;
b.增大n(铁粉):n(碘)的配料比,固体的接触面积不变,反应速率不变,故错误;
c.适当升高反应温度和搅拌速度,可提高反应速率,故正确;
d.向反应器中加水至I2全部溶解,则浓度减小,反应速率减小,故错误;
故选:a c;
(2)步骤ⅡFeI2溶液加入氢氧化钡调节pH值为9.0发生反应生成BaI2溶液和Fe(OH)2沉淀,方程式为:FeI2+Ba(OH)2=Fe(OH)2↓+BaI2;用pH试纸测定溶液pH的方法是把一小块pH试纸放在表面皿上,用玻璃棒蘸取待测溶液点在试纸的中部,试纸变色后,立刻与标准比色卡比较确定溶液的pH,
故答案为:FeI2+Ba(OH)2=Fe(OH)2↓+BaI2;把一小块pH试纸放在表面皿上,用玻璃棒蘸取待测溶液点在试纸的中部,试纸变色后,立刻与标准比色卡比较确定溶液的pH;
(3)使Fe(OH)2颗粒长大便于(步骤Ⅳ)过滤分离;因为活性炭具有吸附性,所以加入活性炭的目的为吸附残留的Fe(OH)2及有机杂质等,
故答案为:便于(步骤Ⅳ)过滤分离;吸附Fe(OH)2及有机杂质等;
(4)由溶解度曲线图可知BaI2的溶解度随温度变化比较大,所以从过滤2所得滤液中获得BaI2•2H2O的方法是蒸发浓缩、冷却结晶,故答案为:蒸发浓缩、冷却结晶.
点评 本题考查物质制备工艺流程,涉及对操作的分析评价、对信息获取与应用等,侧重对化学用语的考查,熟练掌握元素化合物知识,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向甲容器中再充人一定量的氦气 | B. | 向乙容器中再充人2mol的SO3气体 | ||
| C. | 适当降低乙容器的温度 | D. | 缩小甲容器的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盖斯 | B. | 勒•夏特列 | C. | 门捷列夫 | D. | 凯库勒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成物能量一定低于反应物总能量 | |
| B. | 吸热反应和熵减的反应都具有自发进行的倾向 | |
| C. | 正、逆反应速率都改变,化学平衡一定发生移动 | |
| D. | 同温同压下,H2(g)+Cl2(g)?2HCl(g)在光照和点燃条件下的△H相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com