
| A、5 g质量分数为46%的乙醇溶液中,氢原子的总数为0.6 NA |
| B、5.6 g铁与0.1 mol氯气充分反应转移电子数为 0.2 NA |
| C、50 mL 12 mol?L-1 浓盐酸与足量二氧化锰加热反应,转移电子数为0.3 NA |
| D、常温常压下,46 g NO2与N2O4的混合气体中含有的原子总数为3 NA |
| 5g×54% |
| 18g/mol |


科目:高中化学 来源: 题型:
| A、除去乙醇中少量乙酸:加入足量生石灰蒸馏 |
| B、乙烯和乙醇都能使酸性KMnO4溶液褪色 |
| C、实验室里制备少量乙酸乙酯可用饱和Na2CO3溶液接收生成物 |
| D、分离甘油和氯化钠溶液用分液的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
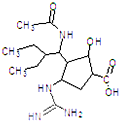 2013年4月5日国家食品药品监督管理局批准了抗H7N9流感新药帕拉米韦氯化钠注射液,帕拉米韦结构如图所示.下列有关说法正确的是( )
2013年4月5日国家食品药品监督管理局批准了抗H7N9流感新药帕拉米韦氯化钠注射液,帕拉米韦结构如图所示.下列有关说法正确的是( )| A、该分子式为C15H28N4O4 |
| B、帕拉米韦能发生取代、加成、消去和氧化反应 |
| C、该分子为难溶于水的药物,遇FeCl3溶液显紫色 |
| D、该分子中含有4种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是次外层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是次外层电子数的3倍,下列说法正确的是( )| A、原子半径:X<Z<W |
| B、非金属性:Y>Z |
| C、最高化合价:X<Y |
| D、最高价氧化物对应水化物的酸性:W>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(NH4)2SO4和CuSO4溶液都能使蛋白质沉淀析出 |
B、苯酚与甲醛在酸性条件下生成酚醛树脂的结构简式为 |
| C、醋酸和硬脂酸互为同系物,C6H14和C9H20也一定互为同系物 |
D、叶酸的结构为 ,它可以发生酯化、水解、加成等反应 ,它可以发生酯化、水解、加成等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 物质 | 起始浓度/(mol?L-1 | 平衡浓度/(mol?L-1 |
| Ⅰ | N2O4 | 0.100 | 0.040 |
| NO2 | 0 | 0.120 | |
| Ⅱ | N2O4 | 0 | 0.014 |
| NO2 | 0.100 | 0.072 |
| A、平衡后,分别压缩容器Ⅰ、Ⅱ,则Ⅰ、Ⅱ中气体颜色都将变深 |
| B、平衡时,Ⅰ、Ⅱ中反应物的转化率a(N2O4)<a(NO2) |
| C、平衡时,Ⅰ、Ⅱ中反应的平衡常数K(Ⅰ)═2K(Ⅱ) |
| D、平衡后,升高相同温度,以N2O4表示的反应速率v(Ⅰ)<v(Ⅱ) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
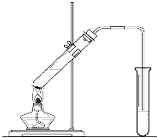 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性就越强.含氧酸酸性强弱与非羟基氧原子数的关系如下表所示:
(1)判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性就越强.含氧酸酸性强弱与非羟基氧原子数的关系如下表所示:| 名称 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 结构式 | Cl-OH | 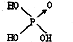 | 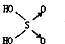 | 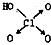 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com