
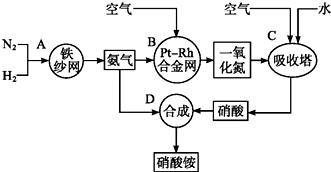
���� ������ͼ��֪��N2��H2�ں�����ɰ���Ĵ������ºϳɰ����������Ϳ����е�O2�ڲ���Ͻ����Ĵ������·�������������NO��H2O����NO�Ϳ�����ˮ��ϣ�NO��O2��ˮ��Ӧ����HNO3��Ȼ��NH3��HNO3��Ӧ����NH4NO3���ݴ˷�����
��� �⣺������ͼ��֪��N2��H2�ں�����ɰ���Ĵ������ºϳɰ����������Ϳ����е�O2�ڲ���Ͻ����Ĵ������·�������������NO��H2O����NO�Ϳ�����ˮ��ϣ�NO��O2��ˮ��Ӧ����HNO3��Ȼ��NH3��HNO3��Ӧ����NH4NO3��
��1��N2��H2�ں�����ɰ���Ĵ������ºϳɰ�������ѧ����ʽΪ��N2+3H2$?_{��}^{��}$2NH3��
�ʴ�Ϊ��N2+3H2$?_{��}^{��}$2NH3��
��2��Bװ������Pt-Rh�Ͻ����Ĵ������£�����������������������Ӧ����NO��H2O����ѧ����ʽΪ��4NH3+5O2$\frac{\underline{\;Pt-Rh�Ͻ���\;}}{\;}$4NO+6H2O��
�ʴ�Ϊ��4NH3+5O2$\frac{\underline{\;Pt-Rh�Ͻ���\;}}{\;}$4NO+6H2O��
��3����D�У�NH3��HNO3��Ӧ����NH4NO3���ʻ�ѧ����ʽΪ��NH3+HNO3=NH4NO3���ʴ�Ϊ��NH3+HNO3=NH4NO3��
��4����C�У���NO�Ϳ�����ˮ��Ϻ�NO��O2��ˮ��Ӧ����HNO3���������������������ʴ�Ϊ�����ÿ����е�������NO������
��5�����ݵ�Ԫ���غ��֪��ϵʽ2NH3������NH4NO3��NH3ת��ΪNO��NOת��ΪHNO3��ת���ʷֱ�Ϊ80%�������Ʊ�1.0tNH4NO3 ��ҪNH3������Ϊ��$\frac{1��1{0}^{6}}{80}$+$\frac{1��1{0}^{6}}{80}$��$\frac{1}{0.8��0.8}$����17g=0.55t���ʴ�Ϊ��0.55t��
���� �����Թ�ҵ�ϳ������Ϊ���壬�����˻�ѧ����ʽ����д����ѧ����ȣ���Ϥ�����ķ�Ӧ����д�ǽ���ؼ�������ʱע��Ԫ���غ��˼���Ӧ�ã���Ŀ�ѶȲ���


 ����ʦ��Сһ����ʦ������ҵϵ�д�
����ʦ��Сһ����ʦ������ҵϵ�д� ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ҵ���Ũ������ڵ�����������ᷢ��������Ӧ | |
| B�� | �Ҵ�������Ʒ�Ӧ | |
| C�� | �Ҵ���Ũ���������µ���ȥ��Ӧ | |
| D�� | �Ҵ���O2�Ĵ�������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ӽ�����֬ | B�� | �����ӽ�����֬ | ||
| C�� | �����ӽ�����֬�������ӽ�����֬ | D�� | ���ӽ�����֬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
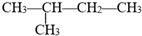 ��ϵͳ������������������2-�����飬����һ�ȴ�����4�֣���������ϩ���������ӳɶ��õ�����ϩ�����ܵĽṹ��ʽ�ǣ�CH2=��CH3��C-CH2-CH3����CH3��2C=CH-CH3����CH3��2CH-CH=CH2��
��ϵͳ������������������2-�����飬����һ�ȴ�����4�֣���������ϩ���������ӳɶ��õ�����ϩ�����ܵĽṹ��ʽ�ǣ�CH2=��CH3��C-CH2-CH3����CH3��2C=CH-CH3����CH3��2CH-CH=CH2���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �γ��������Ҫ���������������͵��������� | |
| B�� | ����Ԫ��--�����ȡ���á������������������Ʊ���������Ԫ�����ξ���������������ԭ���������������� | |
| C�� | ��ɫ��ѧ�ĺ��ľ�����ζԱ���Ⱦ�Ļ����������������� | |
| D�� | ˮ�����ೱ��ˮ����Ⱦ��Ҫ���ɺ�������������ˮ�����ŷ���ɵ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
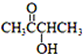 ��������ת����ϵ���� 1mol B��Ӧ������2mol C��
��������ת����ϵ���� 1mol B��Ӧ������2mol C��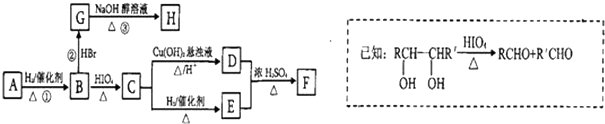
 ��
��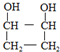 ��
���鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com