
分析 设达到溶解平衡时c(Fe2+)为x,结合Ksp计算x,再结合$\frac{s}{100}$=$\frac{溶质质量}{溶剂质量}$计算.
解答 解:设达到溶解平衡时c(Fe2+)为x.
FeS(s)?Fe2+(aq)+S2-(aq)
x x
则x2=Ksp,x=$\sqrt{8.1×1{0}^{-17}}$=9×10-9 mol/L,
即1L溶液中含FeS的物质的量为9×10-9 mol,
S=$\frac{9×1{0}^{-9}mol×88g/mol}{1000g}$×100=7.92×10-8 g,
答:FeS的溶解度为7.92×10-8 g.
点评 本题考查难溶电解质的溶解度,为高频考点,把握Ksp及溶解度的计算为解答的关键,侧重分析与计算能力的考查,注意计算溶解度时溶剂质量近似为溶液的质量,题目难度不大.


科目:高中化学 来源: 题型:解答题
 是一种具有较好耐热性、耐水性和高频电绝缘性的高分子化合物(树脂),它是由三种单体在一定条件下缩聚(同时还生成水)而成的.这三种单体分别是(写结构简式)C6H5NH2、HCHO和
是一种具有较好耐热性、耐水性和高频电绝缘性的高分子化合物(树脂),它是由三种单体在一定条件下缩聚(同时还生成水)而成的.这三种单体分别是(写结构简式)C6H5NH2、HCHO和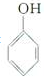 .它们的物质的量之比(按以上回答单体的顺序写)为1:2:1.
.它们的物质的量之比(按以上回答单体的顺序写)为1:2:1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molH2约含有6.02×1023个微粒 | |
| B. | 1mol任何物质都约含有6.02×1023个分子 | |
| C. | 32gO2和O3的混合气体中约含1.204×1024个氧原子 | |
| D. | 1mol氖气中约含有1.204×1024个氖原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
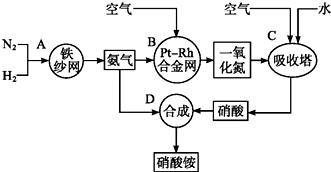
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
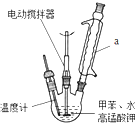 苯甲酸是一种化工原料,常用作制药和染料的中间体,也用于制取增塑剂和香料等.实验室合成苯甲酸的原理、有关数据及装置示意图如下:
苯甲酸是一种化工原料,常用作制药和染料的中间体,也用于制取增塑剂和香料等.实验室合成苯甲酸的原理、有关数据及装置示意图如下: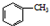 $→_{△}^{KMnO_{4}}$
$→_{△}^{KMnO_{4}}$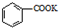 $\stackrel{HCl}{→}$
$\stackrel{HCl}{→}$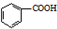
| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 溶解度(g) | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.4[1] | 248 | 1.2659 | 微溶[2] | 易溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
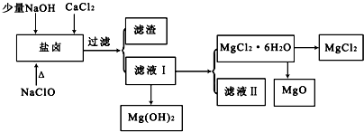
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑥ | ||||||
| 3 | ① | ② | ③ | ⑤ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com