
分析 根据标况下的气体摩尔体积计算出14.2g该气体的物质的量,再根据M=$\frac{m}{n}$计算出该气体的摩尔质量,相对分子质量在数值上等于摩尔质量.
解答 解:标况下4.48L该气体的物质的量为:n=$\frac{V}{{V}_{m}}$=$\frac{4.48L}{22.4L/mol}$=0.2mol,
该气体的摩尔质量为:M=$\frac{14.2g}{0.2mol}$=71g/mol,则该气体的相对分子质量是71.
答:该气体的相对分子质量是71.
点评 本题考查了摩尔质量的计算,题目难度不大,要求学生熟练掌握物质的量与气体摩尔体积、阿伏伽德罗常数、摩尔质量、物质的量浓度等之间的转化关系,试题培养了所学灵活应用所学知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 3.7 g的2H35Cl含质子数为1.9NA | |
| B. | 16 g O3和O2混合物中氧原子数为NA | |
| C. | 100 mL 1 mol•L-1AlCl3溶液中含的阳离子数等于0.1NA | |
| D. | 标准状况下,33.6 L氯气与28 g铁充分反应,转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
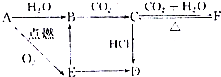
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
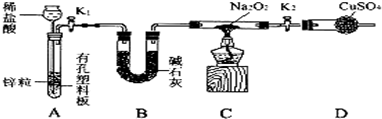
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,M中阴离子的离子符号为O22-.
,M中阴离子的离子符号为O22-.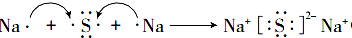 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
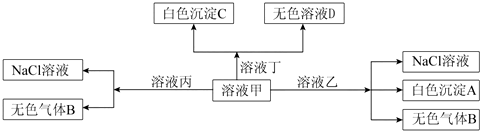
| A. | 溶液乙一定为AlCl3溶液 | |
| B. | 溶液丙与I-、NO3-、SO42-、K+一定可以大量共存 | |
| C. | 在甲中加丁可能发生反应的离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| D. | 白色沉淀A可能溶解在溶液D中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com