
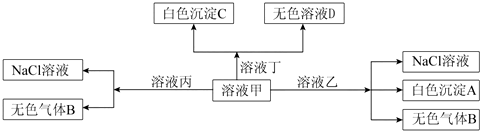
| A. | 溶液乙一定为AlCl3溶液 | |
| B. | 溶液丙与I-、NO3-、SO42-、K+一定可以大量共存 | |
| C. | 在甲中加丁可能发生反应的离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| D. | 白色沉淀A可能溶解在溶液D中 |
分析 甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO3-离子中的两种组成,由离子共存,H+只能与Cl-组成HCl,Al3+只能与Cl-组成AlCl3,甲溶液能和乙溶液生成白色沉淀A、气体和氯化钠,应是铝离子与碳酸氢根发生的双水解反应,A为Al(OH)3,B为CO2,甲、乙分别为AlCl3、NaHCO3中的一种,甲与丙反应得到氯化钠与二氧化碳,则甲为NaHCO3,乙为AlCl3,丙为HCl,甲与丁反应得到白色沉淀C与无色反应D,则丁为Ba(OH)2,由于物质的用量不确定,则D为NaOH或碳酸钠,据此分析.
解答 解:甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO3-离子中的两种组成,由离子共存,H+只能与Cl-组成HCl,Al3+只能与Cl-组成AlCl3,甲溶液能和乙溶液生成白色沉淀A、气体和氯化钠,应是铝离子与碳酸氢根发生的双水解反应,A为Al(OH)3,B为CO2,甲、乙分别为AlCl3、NaHCO3中的一种,甲与丙反应得到氯化钠与二氧化碳,则甲为NaHCO3,乙为AlCl3,丙为HCl,甲与丁反应得到白色沉淀C与无色反应D,则丁为Ba(OH)2,由于物质的用量不确定,则D为NaOH或碳酸钠.
A.由分析可知,溶液乙一定为AlCl3溶液,故A正确;
B.丙为HCl,含有H+,故I-、NO3-不能与其共存,故B错误;
C.甲为NaHCO3,丁为Ba(OH)2,在甲中滴加丁,若氢氧化钡过量,发生反应:HCO3+Ba2++OH-=BaCO3↓+H2O,故C正确;
D.A为Al(OH)3,D可能为NaOH,所以白色沉淀A可能溶解在溶液D中,故D正确,
故选:B.
点评 本题考查无机物推断、物质的检验,关键是根据反应现象进行判断,需要学生熟练掌握离子间发生反应,较好的考查学生分析推理能力,难度中等.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:解答题
 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=1.0×10-12mol•L-1的溶液中:K+、AlO2-、NO3-、Na+ | |
| B. | pH=0的溶液:Fe2+、Br-、Na+、NO3- | |
| C. | 强酸性溶液中:Fe3+、K+、SCN-、SO42- | |
| D. | 石蕊试液呈紫色的溶液中:NH4+、Al3+、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用无水硫酸铜可检验酒精中是否有水 | |
| B. | 加生石灰进行过滤,可除去酒精中的水 | |
| C. | 用酒精可萃取出碘水中的碘 | |
| D. | 医院用100%酒精进行杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molH2约含有6.02×1023个微粒 | |
| B. | 1mol任何物质都约含有6.02×1023个分子 | |
| C. | 32gO2和O3的混合气体中约含1.204×1024个氧原子 | |
| D. | 1mol氖气中约含有1.204×1024个氖原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
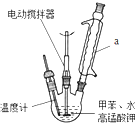 苯甲酸是一种化工原料,常用作制药和染料的中间体,也用于制取增塑剂和香料等.实验室合成苯甲酸的原理、有关数据及装置示意图如下:
苯甲酸是一种化工原料,常用作制药和染料的中间体,也用于制取增塑剂和香料等.实验室合成苯甲酸的原理、有关数据及装置示意图如下: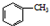 $→_{△}^{KMnO_{4}}$
$→_{△}^{KMnO_{4}}$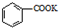 $\stackrel{HCl}{→}$
$\stackrel{HCl}{→}$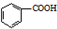
| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 溶解度(g) | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.4[1] | 248 | 1.2659 | 微溶[2] | 易溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 3:2 | D. | 3:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com