
分析 ①将固体溶于水,搅拌后得到无色透明溶液,则一定不含CuSO4;
②往此溶液中滴加氯化钡溶液,有白色沉淀生成,白色沉淀为碳酸钡或硫酸钡;
③过滤,将沉淀置于稀盐酸中,发现沉淀不溶解,结合②可知白色沉淀只能为硫酸钡,则原混合物一定不含Na2CO3,一定含Na2SO4,以此来解答.
解答 解:①将固体溶于水,搅拌后得到无色透明溶液,则一定不含CuSO4;
②往此溶液中滴加氯化钡溶液,有白色沉淀生成,白色沉淀为碳酸钡或硫酸钡;
③过滤,将沉淀置于稀盐酸中,发现沉淀不溶解,结合②可知白色沉淀只能为硫酸钡,则原混合物一定不含Na2CO3,一定含Na2SO4,
(1)由上述分析可知,固体混合物中肯定含有Na2SO4,生成白色沉淀的化学方程式为Na2SO4+BaCl2=BaSO4↓+2NaCl,肯定没有CuSO4、Na2CO3,可能含有NH4Cl,
故答案为:Na2SO4;Na2SO4+BaCl2=BaSO4↓+2NaCl;CuSO4、Na2CO3;NH4Cl;
(2)检验是否含有可能存在的物质的实验方法是:取少量的无色透明溶液置于试管中,向试管中加入适量的NaOH浓溶液,加热试管,吧湿润的红色石蕊试纸靠近试管口,惹试纸变蓝则含有 NH4Cl,否则不含NH4Cl,其化学方程式为,
故答案为:取少量的无色透明溶液置于试管中,向试管中加入适量的NaOH浓溶液,加热试管,吧湿润的红色石蕊试纸靠近试管口,惹试纸变蓝则含有 NH4Cl,否则不含NH4Cl;NH4Cl+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+NH3↑+H2O.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与推断能力的考查,注意白色沉淀的判断,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
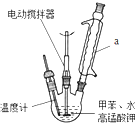 苯甲酸是一种化工原料,常用作制药和染料的中间体,也用于制取增塑剂和香料等.实验室合成苯甲酸的原理、有关数据及装置示意图如下:
苯甲酸是一种化工原料,常用作制药和染料的中间体,也用于制取增塑剂和香料等.实验室合成苯甲酸的原理、有关数据及装置示意图如下: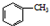 $→_{△}^{KMnO_{4}}$
$→_{△}^{KMnO_{4}}$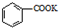 $\stackrel{HCl}{→}$
$\stackrel{HCl}{→}$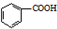
| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 溶解度(g) | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.4[1] | 248 | 1.2659 | 微溶[2] | 易溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
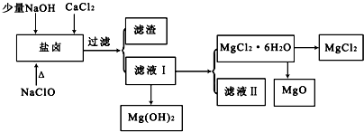
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
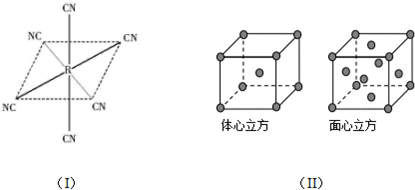
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
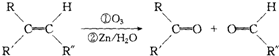
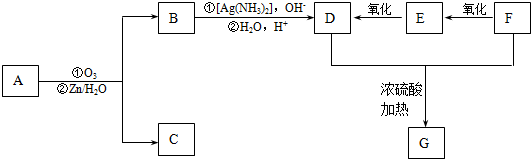
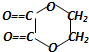 +2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.
+2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 3:2 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑥ | ||||||
| 3 | ① | ② | ③ | ⑤ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
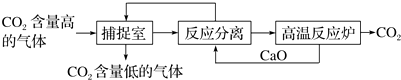
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com