
甲酸甲酯水解反应方程式为:HCOOCH3 + H2O  HCOOH + CH3OH – Q(Q>0)
HCOOH + CH3OH – Q(Q>0)
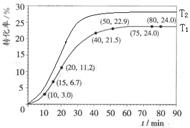
某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表。甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:
| 组分 | 物质的量/mol |
| HCOOCH3 | 1.00 |
| H2O | 1.99 |
| HCOOH | 0.01 |
| CH3OH | 0.52 |

(1) (1分)
(1分)
(2)0.045 , 9.0×10-3, 0(3分)
(3)该反应中甲酸具有催化作用,甲酸量逐渐增多,催化效果显著,反应速率明显增大。(2分)
(4) (2分)
(2分)
解析试题分析:
(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的化学方程式可知,平衡常数 。
。
(2)根据图中的转化率可知,15min时甲酸甲酯的转化率是6.7%,则消耗甲酸甲酯的物质的量是0.067mol。20min时甲酸甲酯的转化率是11.2%,则消耗甲酸甲酯的物质的量是0.112mol,所以在15~20min内甲酸甲酯减少了0.112mol-0.067mol=0.045。则甲酸甲酯的平均反应速率为0.045mol÷5min=0.009mol/min;根据图像可知,80min后反应物的转化率不再发生变化,说明反应已经达到平衡状态,则80~90min范围内甲酸甲酯的平均反应速率为0。
(3)由于在该反应中甲酸具有催化作用,随着反应的进行,甲酸量逐渐增多,催化效果显著,反应速率明显增大。
(4)正反应是吸热反应,所以升高温度,反应物的转化率增大。且反应速率快,达到平衡的时间少,即图像是(见答案)。
考点:化学反应速率、化学平衡、化学平衡常数


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:计算题
某温度下,在一固定容积的密闭容器中投入一定物质的量的N2与H2进行可逆反应:N2(g)+3H2(g)  2NH3(g) 在2 min时达到平衡状态,此时c(N2)=5.00 mol/L,c(H2)=10.00mol/L,c(NH3)=5.00 mol/L。试求:(写出解题过程)
2NH3(g) 在2 min时达到平衡状态,此时c(N2)=5.00 mol/L,c(H2)=10.00mol/L,c(NH3)=5.00 mol/L。试求:(写出解题过程)
(1)该温度下,反应的平衡常数是多少?
(2)H2的起始浓度;
(3)用N2表示该反应的反应速率是多少;
(4)N2的转化率(保留三位有效数字);
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(18分)铵盐在工农业生产中有着重要的用途,请根据要求完成下列各题。
Ⅰ.某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液。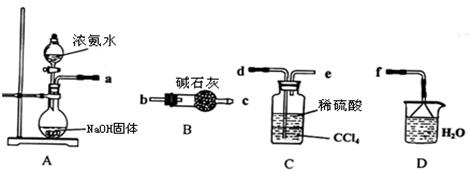
(1)仪器连接的顺序(用接口序号字母表示)是:a
(2)试从电离平衡角度分析该实验装置A中能产生氨气的原因:
。
(3)将装置C中两种液体分离开的操作名称是 。
(4)(NH4)2SO4“低毒,有刺激性,有吸湿性、吸湿后固结成块”。储存应注意 。
Ⅱ.为提高氯化铵的经济价值,我国化学家设计了利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁[Mg(OH)Cl]的工艺。某同学根据该原理设计的实验装置如图: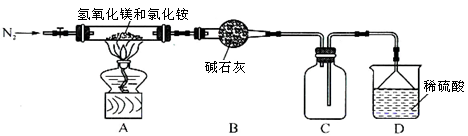
请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为 。
(2)反应过程中持续通入N2的作用有两点:一是使反应产生的氨气完全导出并被稀硫酸充分吸收,
二是 。
(3)由MgCl2溶液蒸发得到MgCl2·6H2O晶体,蒸发的目的是_________。
a.得到热饱和溶液 b.析出晶体
(4)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是:
。
②由MgCl2·6H2O制备无水MgCl2的操作在 氛围中进行,若在空气中加热,则会生成Mg(OH)Cl。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某探究小组用测量HNO3与大理石反应过程中因二氧化碳逸出质量减小的方法,研究影响反应速率的因素。限选试剂:(实验过程中不考虑稀硝酸的挥发)
1.0mol·L-1 HNO3、2.0mol·L-1 HNO3、细颗粒大理石、粗颗粒大理石、35 ℃水浴
(1)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol·L-1 |
| ① | 常温 | 粗颗粒大理石 | |
| ② | 常温 | 粗颗粒大理石 | 2.0 |
| ③ | | 粗颗粒大理石 | 2.0 |
| ④ | 常温 | | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快。由此判断,影响化学反应速率的因素有 和 。
(2)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 体积/mL | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
下表是稀硫酸与某金属反应的实验数据:
| 实验序号 | 金属质量/g | 金属状态 | c(H2SO4) /mol·L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 2 | 0.10 | 块状 | 0.8 | 50 | 20 | 35 | 200 |
| 3 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 4 | 0.10 | 块状 | 1.0 | 50 | 20 | 35 | 125 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:常温下浓度为0.1 mol·L-1的下列溶液的pH如表:
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
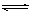 HClO + OHˉ的平衡常数K≈10ˉ7.6
HClO + OHˉ的平衡常数K≈10ˉ7.6查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
A.草酸氢钾溶液呈酸性,在0.1mol·L-1KHC2O4溶液中:c(C2O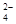 )>c(H2C2O4) )>c(H2C2O4) |
B.在小苏打水溶液中:c(Na+)+c(H+)=c(HCO )+c(CO )+c(CO )+c(OH-) )+c(OH-) |
| C.相同温度下,1 mol/L氨水溶液与0.5mol/L氨水溶液中,c(OH-)之比是2:1 |
D.当氨水与盐酸恰好完全反应时,c(NH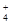 )>c(Cl-)>c(H+)>c(OH-) )>c(Cl-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.向蒸馏水中滴加浓H2SO4时,KW不变 |
| B.常温下,0.005mol·L-1Ba(OH)2溶液pH为12 |
C.Na2CO3水解的离子方程式为:CO32- + 2H2O H2CO3+ 2OH- H2CO3+ 2OH- |
| D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com