
分析 依据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$,ρ=$\frac{m}{V}$来计算,结合分子中原子的组成分析.
解答 解:已知CO2的摩尔质量为44g/mol,该气体质量为22g,则:
(1)该气体的物质的量为n=$\frac{m}{M}$=$\frac{22g}{44g/mol}$=0.5mol;故答案为:0.5mol;
(2)该气体在标准状况下的体积为V=nVm=0.5mol×22.4L/mol=11.2L;故答案为:11.2;
(3)该气体在标准状况下的密度为ρ=$\frac{m}{V}$=$\frac{22g}{11.2L}$=1.96g/L;故答案为:1.96;
(4)该气体所含分子的物质的量为0.5mol,则原子的物质的量为1.5mol,所以原子总数为1.5NA;故答案为:1.5NA.
点评 本题考查了物质的量和质量、摩尔质量以及体积和M、Vm之间关系的计算,掌握概念和换算定量关系是解题关键,题目较简单..


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:选择题
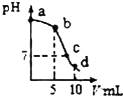 25℃时,向10mL0.2mol•L-1NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如如图所示.,则下列说法不正确的是( )已知:Ka(HCN)=6.4×10-10.
25℃时,向10mL0.2mol•L-1NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如如图所示.,则下列说法不正确的是( )已知:Ka(HCN)=6.4×10-10.| A. | a点时,CN-离子浓度大于其他点 | B. | b点时,c(HCN)>c(CN-) | ||
| C. | c点时,c(Na+)=c(Cl-)+c(CN-) | D. | d点时,溶液的c(H+)≈8×10-5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为16的氧原子:${\;}_{16}^{8}$O | |
| B. | 苛性钠化学式:Na2CO3 | |
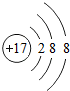
| C. | 镁离子结构示意图: | |
| D. | 次氯酸钠在水中电离:NaClO═Na++Cl-+O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2(s)与CO2(g)反应时,放出226kJ热量 | |
| B. | CO的燃烧热为△H=-566kJ/mol | |
| C. | CO(g)与Na2O2 (S)反应的热化学方程式为:Na2O2(s)+CO(g)═Na2CO3(s)△H=-509kJ•mol-1 | |
| D. | 2Na2O2(s)+2CO2(g)═2Na2CO3(s)+O2(g)△H=-452kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x+y<z | B. | 平衡向右移动 | C. | B的转化率升高 | D. | C的体积分数降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2++2OH-═Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+═CO2↑+H2O BaCO3+2HCl═BaCl2+CO2↑+H2O | |
| C. | Ca2++CO32-═CaCO3↓ Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3 | |
| D. | H++OH-═H2O Ba(OH)2+H2SO4═BaSO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
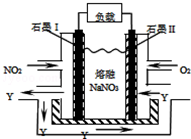 碳和氮的许多化合物在工农业生产和生活中有重要的作用.
碳和氮的许多化合物在工农业生产和生活中有重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质 | B. | 氧化物 | C. | 无机物 | D. | 有机物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com