
| A. | x+y<z | B. | 平衡向右移动 | C. | B的转化率升高 | D. | C的体积分数降低 |
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题
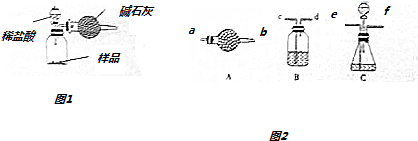
| 选用的仪器 | |||||
| 添加的药品(或必要的操作) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①是置换反应 | B. | ①②均属于氧化还原反应 | ||
| C. | 每消耗1mol TiO2会生成56g CO | D. | 反应②中镁元素化合价升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 门捷列夫 | B. | 盖斯 | C. | 勒夏特列 | D. | 范德华 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室可用NaOH溶液处理NO2和HCl废气 | |
| B. | 实验室可用浓硫酸干燥氨气 | |
| C. | 漂白粉的成分为次氯酸钙 | |
| D. | SO2可用于漂白食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
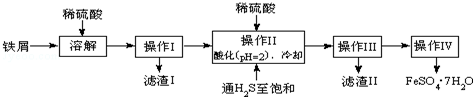
| 25℃时 | pH值 | 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com