
| n(碱)-n(酸) |
| V(酸)+V(碱) |
| n(碱)-n(酸) |
| V(酸)+V(碱) |
| 0.01mol/L×0.1L-0.01mol/L×VL |
| 0.1L+VL |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
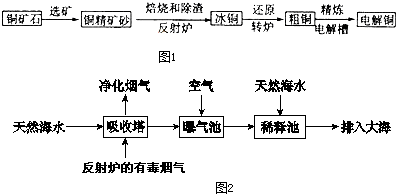
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K2CO3、Ba(NO3)2、KOH、HNO3 |
| B、Ba(NO3)2、KOH、HNO3、K2CO3 |
| C、KOH、K2CO3、Ba(NO3)2、HNO3 |
| D、Ba(NO3)2、KOH、K2CO3、HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入稀盐酸产生气体,将气体通入澄清石灰水,溶液变浑浊,可能有CO32- |
| B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C、加硝酸银溶液产生白色沉淀,一定有Cl- |
| D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 混合物 | 除杂试剂 | 分离方法 | |
| A | 溴苯(溴) | NaOH溶液 | 分液 |
| B | 乙烷(乙烯) | 酸性KMnO4 | 洗气 |
| C | 甲苯(苯酚) | 溴水 | 过滤 |
| D | 溴乙烷(乙醇) | NaOH溶液 | 分液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在密闭容器中进行如下反应:H2(g)+I2(g)?2HI(g),在温度T1和T2时,产物的量与反应的时间的关系如图所示符合图示的正确判断是( )
在密闭容器中进行如下反应:H2(g)+I2(g)?2HI(g),在温度T1和T2时,产物的量与反应的时间的关系如图所示符合图示的正确判断是( )| A、T1>T2,△H>0 |
| B、T1<T2,△H<0 |
| C、T1<T2,△H>0 |
| D、T1>T2,△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定条件 |
| (1) |
| 一定条件 |
| (2) |
| 一定条件 |
| (3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com