
| V |
| Vm |
| n |
| V |
| 1.12L |
| 22.4L/mol |
| 6.2g |
| 62g/mol |
| 0.4mol |
| 0.1L |


科目:高中化学 来源: 题型:
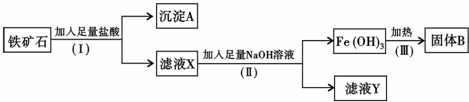
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 完全沉淀的pH | 5.2 | 3.2 | 9.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
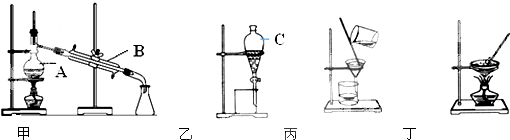

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、②①③ |
| C、③②① | D、①③② |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、蒸发时,蒸发皿内所盛液体不超过蒸发皿容积的
| ||
| B、蒸发结晶时,不能直接蒸干液体,最后少量液体用余热蒸干 | ||
| C、用四氯化碳萃取碘水中的碘,分液时四氯化碳碘溶液从上口倒出 | ||
| D、蒸馏时,要在烧瓶中加入几粒碎瓷片 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 分馏又称为分级蒸馏或精馏.适用于互溶而且沸点相差很小的多组分混合液的分离.控制好温度,便可将各种物质分离.有关分馏操作,下列说法正确的是( )
分馏又称为分级蒸馏或精馏.适用于互溶而且沸点相差很小的多组分混合液的分离.控制好温度,便可将各种物质分离.有关分馏操作,下列说法正确的是( )| 1 |
| 3 |
| 1 |
| 4 |
| A、①③④ | B、②③④ |
| C、③④⑤ | D、②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 -C≡C-CH=CH-CH3,有关其结构说法正确的是( )
-C≡C-CH=CH-CH3,有关其结构说法正确的是( )| A、该分子中有6个碳原子一定在同一条直线上 |
| B、该分子中有8个碳原子可能在同一条直线上 |
| C、该分子中所有碳原子一定都在同一平面上 |
| D、该分子中所有氢原子可能在同一平面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com