
【题目】下列各反应,能用同一离子方程式表示的是( )
A.氢氧化铜与盐酸; 氢氧化铜与醋酸
B.氯化钡溶液与硫酸铜溶液; 氢氧化钡溶液与硫酸铜溶液
C.碳酸氢钠溶液与稀硫酸 碳酸钠溶液与稀硫酸
D.石灰石与稀硝酸 石灰石与稀盐酸
【答案】D
【解析】解:A.氢氧化铜与盐酸、氢氧化铜与醋酸反应的离子方程式分别为:Cu(OH)2+2H+=Cu2++2H2O、Cu(OH)2+2CH3COOH=Cu2++2CH3COO﹣+2H2O,所以离子方程式不同,故A错误;B.氯化钡溶液与硫酸铜溶液、氢氧化钡溶液与硫酸铜溶液反应离子方程式分别为:Ba2++SO ![]() =BaSO4↓、Ba2++2OH﹣+SO
=BaSO4↓、Ba2++2OH﹣+SO ![]() +Cu2+=BaSO4↓+Cu(OH)2↓,所以离子方程式不同,故B错误;
+Cu2+=BaSO4↓+Cu(OH)2↓,所以离子方程式不同,故B错误;
C.小苏打为碳酸氢钠,而苏打为碳酸钠,阴离子不同,且HCO ![]() 、CO
、CO ![]() 在离子反应中均保留整体,碳酸钠与盐酸反应的离子方程式为CO
在离子反应中均保留整体,碳酸钠与盐酸反应的离子方程式为CO ![]() +2H+=CO2↑+H2O,碳酸氢钠与盐酸反应的离子方程式为:HCO
+2H+=CO2↑+H2O,碳酸氢钠与盐酸反应的离子方程式为:HCO ![]() +H+=CO2↑+H2O,不能用同一离子反应表示,故C错误;
+H+=CO2↑+H2O,不能用同一离子反应表示,故C错误;
D.硝酸和HCl都是强电解质,都需要拆开,两个反应离子方程式都是CaCO3+2H+=Ca2++CO2↑+H2O,满足条件,故D正确;
故选D.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】甲是一种可用于净水和膨化食品的盐,由A,B,C,D,E五种短周期元素组成.甲溶于水后可电离出三种离子,其中一种是由A、B形成的10电子阳离子.A元素原子核内质子数比E的少l,D,E同主族.某同学为探究甲的组成而进行如下实验:
①取mg甲的晶体溶于蒸馏水,配成500mL溶液;
②取少量甲溶液于试管中,逐滴滴入Ba(OH)2溶液,生成沉淀的物质的量与滴入Ba(OH)2溶液体积的关系如图所示;
③取20mL甲溶液于试管中,加入过量NaOH溶液后加热并收集产生的气体,然后折算成标准状况下的体积为224mL.
回答下列问题:
(1)D在元素周期表中的位置为 .
(2)经测定晶体甲的摩尔质量为453gmol﹣1 , 其中阳离子和阴离子物质的量之比为1:1. 则晶体甲的化学式为 .
(3)图象中V(Oa):V(ab):V(bc)= 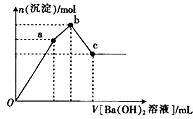
(4)写出ab段发生反应的离子方程式: .
(5)配成的甲溶液物质的量浓度是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁涉及到的化学反应有:①CaO+H2O=Ca(OH)2、②Mg2++2OH﹣=Mg(OH)2↓、③Mg(OH)2+2HCl=MgCl2+2H2O、④MgCl2 ![]() Mg+Cl2↑没有涉及到的反应类型是( )
Mg+Cl2↑没有涉及到的反应类型是( )
A.化合反应
B.分解反应
C.置换反应
D.复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香烃A有如下转化关系: 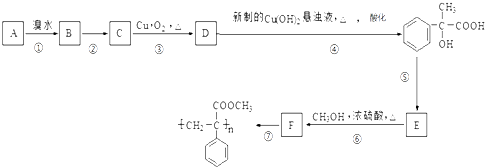
按要求填空:
(1)写出D中所含官能团的名称 , 指出⑤的反应类型 .
(2)反应②的反应条件是
(3)写出A和F结构简式:A;F
(4)写出反应③对应的化学方程式:
(5)写出D与新制Cu(OH)2悬浊液反应的化学方程式:
(6)E符合下列条件的同分异构体有多种,任写其中一种能同时满足下列条件的异构体的结构简式 .
a.苯环上的一氯代物有两种
b.遇FeCl3溶液发生显色反应
c.能与Br2/CCl4发生加成反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( ) 
A.2:7
B.5:4
C.4:5
D.7:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.
Ⅰ.以氨为原料,合成尿素的反应原理为:
2NH3(g)+CO2(g)═CO(NH2)2(l)+H2O(g)△H=a kJ/mol.
为研究平衡时CO2的转化率与反应物投料比( ![]() )及温度的关系,研究小组在10L恒容密闭容器中进行模拟反应,并绘出如图(Ⅰ、Ⅱ曲线分别表示在不同投料比时,CO2的转化率与温度之间的关系).
)及温度的关系,研究小组在10L恒容密闭容器中进行模拟反应,并绘出如图(Ⅰ、Ⅱ曲线分别表示在不同投料比时,CO2的转化率与温度之间的关系).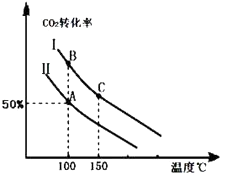
(1)a0 (填“>”或“<”),判断依据是 .
(2)①投料比:Ⅱ(填“>”或“<”).
②若n(CO2)起始=10mol,曲线Ⅱ的投料比为0.4,在100℃条件下发生反应,达平衡至A点,则A点与起始压强比为 .
③A点平衡常数与B点平衡常数间的关系:KAKB(填“>”或“<”或“=”).B点正反应速率与C点正反应速率间的关系为:v(B)v(C)(填“>”或“<”或“=”).
(3)若按曲线Ⅰ的投料比投料,在上述实验中压缩容器体积至5L,在图中画出反应达平衡时的二氧化碳的转化率与温度之间的关系曲线.
(4)为提高CO2转化率可以采取的措施是 .
a.使用催化剂 b.及时从体系中分离出部分CO(NH2)2c.将体系中的水蒸气液化分离
氨气可用于工业上生产硝酸,其尾气中的NO2可用氨水吸收生成硝酸铵,25℃时,将10molNH4NO3溶于水,溶液显酸性,向该溶液中滴加1L某浓度的氨水,溶液呈中性,则滴加氨水的过程中水的电离平衡将(填“正向”、“逆向”或“不”) 移动,此中性溶液中NH3H2O的物质的量为mol.(25℃时,NH3H2O的电离平衡常数Kb=2×10﹣5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据下图判断,下列叙述正确的是( ) 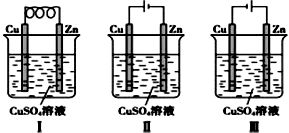
A.Ⅰ是原电池,Ⅱ是电镀装置
B.Ⅰ、Ⅱ装置中锌极上均发生氧化反应
C.Ⅱ、Ⅲ装置中,铜极均发生氧化反应而溶解
D.Ⅱ、Ⅲ装置中Cu2+浓度基本不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com