
【题目】依据下图判断,下列叙述正确的是( ) 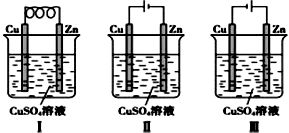
A.Ⅰ是原电池,Ⅱ是电镀装置
B.Ⅰ、Ⅱ装置中锌极上均发生氧化反应
C.Ⅱ、Ⅲ装置中,铜极均发生氧化反应而溶解
D.Ⅱ、Ⅲ装置中Cu2+浓度基本不变
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】根据所学知识,完成下面题目:
(1)同温、同压下等质量的SO3和NO2 , 它们所占的体积比为 , 所含氧元素的物质的量之比为 .
(2)2molO2与1molO3的摩尔质量的比是 .
(3)某化合物的相对分子质量为m,在t℃时A ml该化合物的饱和溶液为B g,将其蒸干后得到固体C g.该化合物在t℃时的溶解度为g,该饱和溶液中溶质的物质的量浓度为mol/L.
(4)实验室制取氯气的化学方程式为:4HCl(浓)+MnO2 ![]() Cl2↑+MnCl2+2H2O, 请回答:MnO2与被氧化的HCl的物质的量之比是;用单线桥法标出电子转移的方向和数目: .
Cl2↑+MnCl2+2H2O, 请回答:MnO2与被氧化的HCl的物质的量之比是;用单线桥法标出电子转移的方向和数目: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应,能用同一离子方程式表示的是( )
A.氢氧化铜与盐酸; 氢氧化铜与醋酸
B.氯化钡溶液与硫酸铜溶液; 氢氧化钡溶液与硫酸铜溶液
C.碳酸氢钠溶液与稀硫酸 碳酸钠溶液与稀硫酸
D.石灰石与稀硝酸 石灰石与稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列事实的解释错误的是( )
A.在蔗糖中加入浓H2SO4后出现发黑现象,说明浓H2SO4具有脱水性。
B.浓H2SO4和浓HCl混合可制得氯化氢,说明浓H2SO4是一种难挥发的酸。
C.常温下,浓硫酸可以用铝罐贮存,说明铝与浓H2SO4不反应。
D.反应CuSO4+H2S = CuS↓+H2SO4能进行,说明CuS既不溶于水,也不溶于硫酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂为了生产耐高温植酸酶饲料添加剂,开展了产该酶菌株的筛选、酶的固定化及其特性分析研究,其流程如下图所示。请回答:
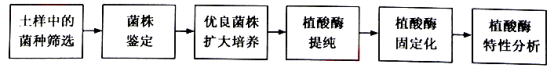
(1)上壤悬液泞先经80℃处理15分钟,其目的是筛选出
(2)在无菌条件下,将经过处理的土壤悬液进行 ,然后涂布于含有植酸钠的固体培养基上。培养后观察到 ,其周围出现透明水解圈,圈的直径大小与 强弱相关。
(3)筛选获得的菌株经鉴定后,将优良菌株进行液体扩大培养。培养时需要振荡,其主要目的是 。液体培养基与固体培养基相比不含有的成分是 。
(4)在合适条件下,将提纯的植酸酶与海藻酸钠混合后,滴加到一定浓度的钙离子溶液中,使液滴形成凝胶固体小球。该过程是对酶进行 。
A.吸附 B.包埋 C.装柱 D.洗涤
(5)温度与植酸酶相对酶活性的关系如图所示。下列叙述错误的是 。
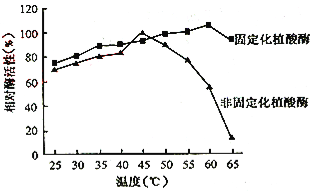
A.测试温度中,固定化与非固定化植酸酶的最适温度分别为60℃和45℃
B.测试温度范围内,固定化植酸酶的相对酶活性波动低于非固定化植酸酶
C.固定化与非固定化植酸酶相比,相对酶活性在80%以上时的温度范围较宽
D.65℃时固定化与非固定化植酸酶的相对酶活性因蛋白质变性而位于最低点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中信息判断,下列选项正确的是( )
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
② | C12、FeBr2 | FeC13、FeBr3 |
③ | MnO | Cl2、Mn2+… |
A.第①组反应的其余产物为H2O
B.第②组反应中Cl2与FeBr2的物质的量之比小于或等于1:2
C.第③组反应中生成1mol Cl2 , 转移电子5mol
D.氧化性由强到弱顺序为MnO ![]() >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩托罗拉公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可以连续使用一个月.已知该电池的总反应式为:2CH3OH+3O2+4KOH ![]() 2K2CO3+6H2O 请填空:
2K2CO3+6H2O 请填空:
(1)放电时:负极的电极反应式为 .
(2)通入甲醇一端的电极是极,电池在放电过程中溶液的pH将(填“上升”、“下降”或“不变”).
(3)若在常温、常压下,1g CH3OH燃烧生成CO2和液态水时放出22.68kJ的热量,表示该反应的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在人类生产、生产中发挥着重要的作用.
(1)钠、铝、铁三种金属元素所形成的各种氧化物中具有强氧化性的是(填化学式,下同);适宜做耐火材料的是 .
(2)若Na2CO3粉末中混有少量NaHCO3杂质,最适宜的除杂方法是 , 反应的化学方程式 .
(3)取少量FeCl2溶液,按如图所示操作,使其跟NaOH溶液反应.可观察到的实验现象是 . 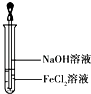
(4)向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是(填序号).
A.有铜无铁
B.有铁无铜
C.铁、铜都有
D.铁、铜都无.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是(填序号),仪器C的名称是 , 本实验所需玻璃仪器E规格和名称是 . 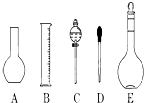
(2)下列操作中,容量瓶所不具备的功能有 (填序号).
A.配制一定体积准确浓度的标准溶液
B.长期贮存溶液
C.用来加热溶解固体溶质
D.量取一定体积的液体
(3)在配制NaOH溶液实验中,其他操作均正确.若定容时仰视刻度线,则所配制溶液浓度0.1mol/L(填“大于”“等于”或“小于”,下同).若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度0.1mol/L.
(4)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为mL(计算结果保留一位小数).如果实验室有10mL、25mL、50mL量筒,应选用mL规格的量筒最好.
(5)如果定容时不小心超过刻度线,应如何操作 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com