
请回答下列问题:
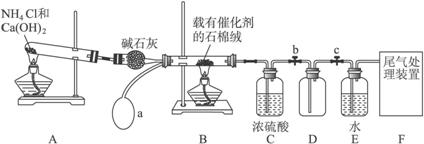
(1)写出装置A中主要反应的化学方程式______________________________________。
(2)已知1 mol NO2与液态水反应生成HNO3溶液和NO气体放出热量46 kJ,写出该反应的热化学方程式_______________________________________________________________。
该反应是一个可逆反应,欲提高NO2的转化率,可采取的措施是___________________。
A.降低温度 B.升高温度
C.减小压强 D.增大压强
(3)实验结束后,关闭止水夹b、c,将装置D浸入冰水中,现象是___________________。
(4)装置C中浓H2SO4的作用是_____________________________________________。
(5)请你帮助该化学小组设计实验室制取NH3的另一方案____________________________。
(6)干燥管中的碱石灰用于干燥NH3,某同学思考是否可用无水氯化钙代替碱石灰,并设计下图所示装置(仪器固定装置省略未画)进行验证。实验步骤如下:

①用烧瓶收集满干燥的氨气,立即塞上如图所示的橡胶塞。
②正立烧瓶,使无水氯化钙固体滑入烧瓶底部,摇动,可观察到的现象是__________________,由此,该同学得出结论:不能用CaCl2代替碱石灰。
科目:高中化学 来源: 题型:
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源:2012届甘肃省兰州一中高三上学期期末考试理综试卷(化学部分) 题型:实验题
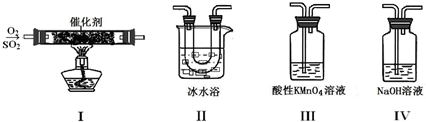
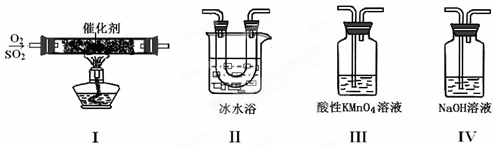
(15分)某校兴趣小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是 。
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省南京学大教育专修学校高一4月月考化学试卷(带解析) 题型:实验题
某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是 。
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |

查看答案和解析>>
科目:高中化学 来源:2011-2012学年武汉二中高二上学期期中考试化学试卷 题型:实验题
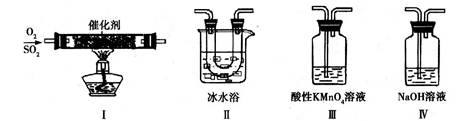
某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示的3组,第2组中物质X的化学式是 。
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
查看答案和解析>>
科目:高中化学 来源:2013届武汉二中高二上学期期中考试化学试卷 题型:实验题
某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示的3组,第2组中物质X的化学式是 。
|
第1组 |
第2组 |
第3组 |
|
S(单质) |
SO2、X、Na2SO3、NaHSO3 |
SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2-76.1℃,SO3 16.8℃;沸点:SO2-10℃,SO3 45℃)
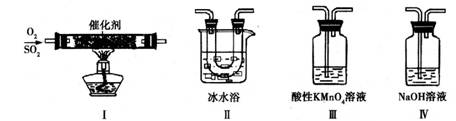
①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ;
装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是
。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有70mL 2mol·L-1NaOH溶液,反应后增重5.12g,则装置Ⅳ中发生反应的化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com