
某小组同学以碳棒为电极电解CuCl2溶液时,发现阴极碳棒上除了有红色物质析出外,还有少量白色物质析出。为探究阴极碳棒上的产物,同学们阅读资料并设计了如下过程:
Ⅰ.有关资料:铜的化合物颜色性质如下
| 物 质 | 颜色、性质 | 物质 | 颜色、性质 |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 浓溶液呈绿色,稀溶液呈蓝色 |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
Ⅱ.探究实验:
(1)提出假设
①红色物质一定有铜,还可能有Cu2O;
②白色物质为铜的化合物,其化学式可能为__________________________。
(2)实验验证
取电解CuCl2溶液后的阴极碳棒,洗涤、干燥,连接下列装置进行实验,验证阴极产物,

①实验前,检查装置A气密性的方法是_______________________________。
②实验时,各装置从左至右的连接顺序为
A→_______→________→B→________→________。
(3)观察现象,得出结论
实验结束后,碳棒上的白色物质变为红色,F中物质不变色,D中出现白色沉淀,根据现象①碳棒上的红色物质是否有Cu2O (填“是”或“否”),理由是_________________________________________;
②装置________(填上图中装置编号)中________的现象说明提出假设②中的白色物质一定存在;
③写出装置B中发生反应的化学方程式___________________________ _。
(4)问题讨论
①电解CuCl2溶液后的阴极上发生的反应为:______________________
和_______________________________________________________________;
②实验过程中,若装置B中的空气没有排净就开始加热,可能对实验造成的影响是______。
(1)②CuCl(1分)
(2)①将橡胶管套在导气管上,用弹簧夹夹紧橡胶管,向分液漏斗中注入水,打开分液漏斗活塞,水的液面不会连续下降,证明装置A的气密性好(其他合理答案也可) (2分)
②E C F D(2分)
(3)①否(1分) F中物质不变蓝色(1分) ②D(1分) 出现白色沉淀(1分)
③2CuCl+H2 2Cu+2HCl(1分)
2Cu+2HCl(1分)
(4)①Cu2++Cl-+e-=CuCl↓(1分) Cu2++e-=Cu(1分)
②氢气和氧气混合加热可能发生爆炸;空气中水蒸气会干扰Cu2O是否存在的判断(2分)
【解析】(1)阴极主要发生Cu2+得电子反应,及Cu2++2e-=Cu,也可能发生反应:Cu2++e-=Cu+、Cu++Cl-=CuCl↓,CuCl为白色沉淀。
(2)~(4)由所给装置图可知,验证阴极产物的实验原理为:使氢气与阴极产物在高温下反应,由其反应产物确定阴极产物;实验方法为:首先制取氢气、并除杂、干燥,将纯净的氢气通过灼热的阴极碳棒后,再通过无水硫酸铜,验证是否生成水,若无水硫酸铜变蓝,则说明有水生成,可进一步说明阴极碳棒有Cu2O生成,否则,没有Cu2O生成;再通入硝酸银溶液看是否有沉淀生成,若硝酸银溶液中有白色沉淀生成,则该白色沉淀为氯化银,说明反应中有氯化氢气体生成,进一步说明阴极碳棒上有CuCl生成,否则,说明阴极碳棒上没有CuCl生成。装置的连接顺序为:A→E→C→B→F→D。实验中无水硫酸铜不变色,而硝酸银溶液中有白色沉淀,说明阴极碳棒上没有Cu2O而有Cu和CuCl,故硬质玻璃管中发生的反应为:2CuCl+H2 2Cu+2HCl。进而可推出电解时阴极发生的反应除生成Cu外,还生成CuCl。
2Cu+2HCl。进而可推出电解时阴极发生的反应除生成Cu外,还生成CuCl。


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1 mol羟基( )中含有的电子数为0.7 NA
)中含有的电子数为0.7 NA
B.1 L 0.1 mol·L-1的AlCl3 溶液中含有Al3+的数目为0.1 NA
C.0.1 mol N2与足量H2反应,转移的电子数为0.6 NA
D.标准状况下,1.12 L HCHO中C原子的数目为0.05 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学实验小组为了证明铜与稀硝酸反应产生一氧化氮,用如图所示装置进行实验(加热装置和夹持装置均已略去,装置气密性良好,F是用于鼓入空气的双连打气球)。
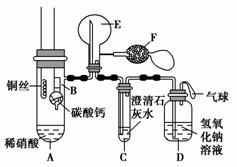
实验操作及现象:
| 实验操作 | 现象 |
| Ⅰ.将B装置下移,使碳酸钙与稀硝酸接触 | 产生气体 |
| Ⅱ.当C装置中产 | |
| Ⅲ.将A装置中铜丝放入稀硝酸中,给A装置微微加热 | A装置中产生无色气体 E装置中开始时出现浅红棕色气体 |
| Ⅳ.用F装置向E装置中鼓入空气 | E装置内气体颜色逐渐加深 |
| Ⅴ.一段时间后 | C装置中白色沉淀溶解 |
试回答下列问题:
(1)操作Ⅰ中产生气体的化学式为___________________________________;
操作Ⅰ的目的是_________________________________________________;
D装置的作用是_________________________________________________。
(2)C装置中白色沉淀的化学式是___________________________________,
操作Ⅱ中当C装置中产生白色沉淀时立刻将B装置上提的原因是_________________________________________________________________。
(3)操作Ⅲ中A装置中产生无色气体的化学方程式是_____________________ _________________________________________________________________。
(4)E装置内气体颜色逐渐加深的原因是__________________________ ________________________________________ _________________________。
_________________________。
(5)操作Ⅴ现象产生的原因是(用化学方程式说明)________________________ _________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,能生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为 ,B为 ,C为 ,D为 。(填元素符号)
(2)D的最高价氧化物的水化物的化学式是 ,E的电子式是 。
(3)写出由A、B组成的化合物与E反应的化学方程式: 。
(4)请用电子式表示出C和D形成的化合物F的形成过程: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、R、W是5种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族, Z、R 、W同周期。下列说法错误的是( )
A.原子半径:Z>R>W
B.W的气态氢化物稳定性强于R的气态氢化物
C.XW4分子中各原子均满足8电子结构
D.Y、Z、R三种元素组成的化合物水溶液一定显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述不正确的是
A.水受热不易分解,与水分子之间存在氢键无关
B.有化学键断裂的变化不一定是化学变化
C.熔化状态下能导电的物质不一定是离子化合物
D.易溶于水的物质一定是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式不正确的是
A. 三氯化铝溶液中加入过量氨水:Al3++4NH3·H2O==4NH4++AlO2—+2H2O
B. 4 mol/L的NaAlO2溶液和7 mol/L的HCl溶液等体积互相均匀混合:
4AlO2—+7H++H2O = 3Al(OH)3↓+Al3+
C. 在Mn2+的溶液中加入HNO3再加入PbO2,得紫红色溶液:
5PbO2+2Mn2++4H+ = 5Pb2++2MnO4—+2H2O
D. 将数滴0.1 mol/L的Na2CO3溶液缓缓滴入0.1 mol/L 25 mL盐酸溶液中:2H++ CO32— =CO2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
I.(10分)四种短周期元素X、Y、Z、W,原子序数依次增大,请结合表中
信息回答下列问题。
| X | Y | Z | W | |
| 结构 或 性质 | X的最高价氧化物对应的水化物与其气态氢化物反应可得到一种盐 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,Z的离子半径最小 | 原子核外最外层电子数是次外层电子数的一半 |
(1)用电子式表示X的氢化物的形成过程_____________________________。
(2)W元素在周期表中的位置为____________________。
(3)上述元素的最高价氧化物对应的水化物中,有一种物质甲与其它三种物质在一定条件下均能发生化学反应,则甲中所含的化学键有________(填序号)。
a.离子键 b.极性共价键 c.非极性共价键 d.氢键
(4)向含有Z元素的简单阳离子的溶液中加入过量的NaOH溶液,发生反应的离子方程式为_____________________________________。
(5)下列可作为比较Z和Mg金属性强弱的方法是_______(填代号)。
a.比较两种元素在化合物中化合价的高低
b.测等浓度相应氯化物水溶液的pH
c.在常温条件下比较单质与浓硝酸反应的剧烈程度
d.在两种金属氯化物的水溶液中分别滴加过量的NaOH溶液
II.(8分)多种物质的转化关系如下图所示(部分反应物或产物已略去,反应条件未列出):

已知:①A、B、C、D、G含有同种元素,且它们的状态与颜色如下表
所示:

②E是通常情况下密度最小的气体;B与AgNO3生成不溶于稀硝酸的白色沉淀;一种气体氧化物M通入B溶液中可被氧化为F,F是含有三种元素的共价化合物,F与A反应生成E和G。
请回答下列问题:
(1)写出下列物质的化学式:D___________;E__________。
(2)写出下列反应的离子方程式:
①B+M→F:________________________________________;
②A+F→E+G:______________________________________。
(3)下列氧化物中能与G溶液反应直接生成C固体的是_______(填字母)。
a.Na2O2 b.SO2 c.CO2 d.BaO2
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表是学习物质结构与性质的重要工具。下表是元素周期表的一部分,表中所列字母A、B、D、E、G、H、Q、M、R分别代表某一化学元素。请用所给元素回答下列问题。
| A | |||||||||||||||||
| M | B | D |
| ||||||||||||||
| G | H |
|
| Q | R | ||||||||||||
| E |
| ||||||||||||||||
(1)Q元素在元素周期表中的位置 ,E元素原子结构示意图为
(2)E、Q、R三种元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)_________________________________。
(3)M、D两元素形成的化合物中含有的化学键类型是 ,其MD2分子的结构式:
(4)用电子式表示物质GDA_________________; 用电子式表示G与Q形成化合物的过程 ;
(5)用表中所给元素组成反应物,请各用一个化学方程式说明元素Q和R非金属性的强弱: ;元素G、H的金属性强弱:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com