
某元素的最高价氧化物的分子式 其中含R27.27%,对此元素的叙述不正确的是( )
其中含R27.27%,对此元素的叙述不正确的是( )
A. 该元素为硫 B. 该元素的气态氢化物含H25%
C.  分子中含极性键 D.
分子中含极性键 D.  与水反应能生成酸
与水反应能生成酸
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.强电解质溶液的导电能力一定强于弱电解质溶液
B.将氢氧化钠和氨水各稀释一倍,两者的氢氧根浓度均减少到原来的1/2
C.物质的量相同的磷酸钠溶液和磷酸溶液中所含磷酸根物质的量相同
D.溶液中有已电离的离子和未电离的分子能说明该物质是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
学生用铝片分别和稀盐酸、稀硫酸反应发现:铝片与稀盐酸反应现象非常明显,而和稀硫酸几乎不反应。为排除因试剂变质等因素造成的影响,该学生在教师的指导下重新进行下列实验,验证是否存在上述现象。
铝与酸反应的情况。结果如下:
反应进程(分钟) 1 2 5 15 20
3.0mol/L盐酸 少量气泡 较多气泡 大量气泡 反应剧烈 铝片耗尽
1.5mol/L硫酸 均无明显现象(无气泡产生)
3.0mol/L硫酸 均无明显现象(无气泡产生)
通过上述实验可知,无论是用1.5mol/L 硫酸还是3.0mol/L 硫酸,均无明显的现象,而3.0mol/L盐酸与铝片反应的现象却十分明显。
(1)反应1~15min 内,铝与盐酸的反应速率逐渐加快,其主要原因是
__________________________ 。
(2)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪些假设或猜想(列出两种即可)?
假设一:_________________________________________________________________
假设二:_________________________________________________________________
(3)通过你的思考,教材中H2O2的分解所用的催化剂(FeCl3和CuSO4)这个实验(关于催化剂对化学反应速率的影响)也需要改进,才具有说服力,应怎样改进
________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
为了检验溴乙烷中含有溴元素,有以下操作,顺序合理的是 ( )
①加AgNO3溶液 ②加NaOH溶液 ③加热 ④加蒸馏水 ⑤加硝酸至溶液显酸性
A.②①③⑤ B.②④⑤③ C.②③⑤① D.②①⑤③
查看答案和解析>>
科目:高中化学 来源: 题型:
氯元素的相对原子质量为35.5,氯只有35Cl和37Cl两种稳定同位素,在氯气中35Cl和37Cl的原子个数比为3∶1,则相对分子质量为70,72,74的氯气分子数之比可能是( )
A.5∶3∶2 B.5∶2∶2
C.5∶2∶1 D.9∶3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是短周期元素,X为地壳中含量最高的金属元素;Y原子最外层电子数是电子总数的2/3;Z的最高正化合价与最低负化合价的代数和为4;W原子在短周期中原子半径最大。下列说法正确的是
A.ZO3和水反应形成的化合物是离子化合物
B.粘在试管内壁上的Z可以用YZ2洗涤
C.最高价氧化物对应水化物的碱性:X>W
D.X位于金属与非金属的分界线处,常用来做半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )。
A.化学方程式为:2M N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下:

已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
Fe3+ | Fe2+ | Zn2+ | |
开始沉淀的pH | 1.1 | 5.8 | 5.9 |
沉淀完全的pH | 3.0 | 8.8 | 8.9 |
请回答下列问题:
⑴试剂X可能是__________,其作用是____________________。
⑵加入ZnO调节pH=3~4的目的是____________________。
⑶由不溶物生成溶液D的化学方程式为______________________________。
⑷由溶液D制胆矾晶体包含的主要操作步骤是______________________________。
⑸下列试剂可作为Y试剂的是______。 A.ZnO B.NaOH C.Na2CO3 D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是______________________________。
⑹测定胆矾晶体的纯度(不含能与I-发生反应的氧化性杂质):准确称取0.5000g胆矾晶体置于锥形瓶中,加适量水溶解,再加入过量KI,用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.40mL。已知:上述滴定过程中的离子方程式如下:
Cu2++4I-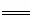 2CuI(白色)↓+I2,I2+2S2O32-
2CuI(白色)↓+I2,I2+2S2O32-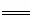 2I-+S4O62-
2I-+S4O62-
①胆矾晶体的纯度为_______________。
②在滴定过程中剧烈摇动(溶液不外溅)锥形瓶,则所测得的纯度将会__________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com