
| A.①③④ | B.①②③ | C.①③⑤ | D.②③④⑤ |
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源:不详 题型:填空题
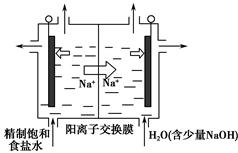
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
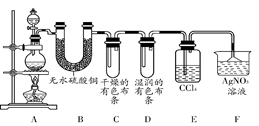
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该混盐中氯元素的化合价为-1 |
| B.该混盐的水溶液呈中性 |
| C.该混盐与盐酸反应产生1 mol Cl2时转移2 mol电子 |
| D.该混盐具有和漂白粉相似的化学性质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 |
| B.通常状况下,干燥的氯气能与Fe反应 |
| C.纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现雾状;光照H2和Cl2的混合气体时,因迅速化合而爆炸 |
| D.氯气能与水反应生成HClO和HCl,久置氯水最终变为稀盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
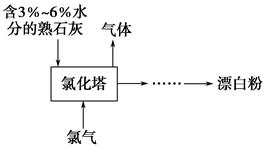
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com