
【题目】在室温下,等体积的酸和碱的溶液混合后,pH一定小于7的是
A.pH=3的HNO3跟pH=11的KOH溶液
B.pH=3的盐酸跟pH=11的氨水
C.pH=3硫酸跟pH=11的氢氧化钠溶液
D.pH=3的醋酸跟pH=11的氢氧化钠溶液
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 向0.1 molL-1CH3COOH溶液中加入少量水,溶液中 减小
减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中  增大
增大
C. 向盐酸中加入氨水至中性,溶液中 >1
>1
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3溶液中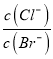 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》中记载了草木灰的获取及使用的过程——“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”。下列有关该记载的说法中,不正确的是( )
A.“以灰淋汁”的操作是过滤B.“薪柴之灰”可与铵态氮肥混合施用
C.“取碱”得到的实际是一种盐溶液D.“浣衣”过程有化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应)。
2NH3(g)(正反应为放热反应)。
(1)当反应达到平衡时,N2和H2的浓度比是___________;N2和H2的转化率比是_____________。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量____________,密度_____________。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_____________(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像中的曲线(纵坐标为沉淀或气体的量,横坐标为加入物质的量),其中错误的是
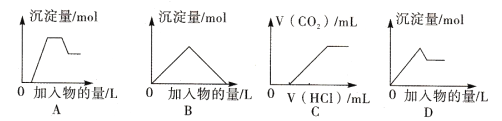
A. 图A表示向含H+、Mg2+、Al3+、NH4+的溶液中滴加NaOH溶液产生沉淀量的关系曲线
B. 图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线
C. 图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线
D. 图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀量的关系曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究化学反应A+B===C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:

(1)该反应为____________(填“放热”或“吸热”)反应。
(2)A和B的总能量比C和D的总能量____________(填“高”或“低”)。
(3)物质中的化学能通过________转化成________释放出来。
(4)反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
(5)写出一个符合题中条件的化学方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)大量应用于玻璃制造业,以硼镁矿(2MgO·B2O3·H2O、SiO2及少量Fe3O4、CaCO3, Al2O3)为原料生产硼酸的工艺流程如下:

已知:ⅰ.Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4。
ⅱ.H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0g、8.7g、14.8g、40.2g。
(1)为了提高硼镁矿粉的浸出率,可采取的措施有 (至少答两条)
(2)“浸出液”显酸性,含H3BO3和Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H2O2和MgO, H2O2的作用是 (用离子方程式表示),MgO除去的杂质离子是 。
(3)已知H3BO3与过量的NaOH反应生成Na[B(OH)4],试写出H3BO3在溶液中的电离方程式 。
(4)“浸取”后,采用“热过滤”的目的是 ,母液中的主要溶质有 。
(5)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如下图,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收MgSO4·H2O,应采取的 措施是将“母液”蒸发浓缩,____________
(6)测定所得产品的纯度:取ag 硼酸,小心加热使其分解脱去水分(杂质受热不分解),得残留固体bg,则产品的纯度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁煅烧反应为2FeSO4(s)![]() SO2(g)+Fe2O3(s)+SO3(g),有关说法正确的是 ( )
SO2(g)+Fe2O3(s)+SO3(g),有关说法正确的是 ( )
A. 该反应中每生成1 mol Fe2O3转移电子数约为1×6.02×1023
B. SO2能使溴水褪色,说明SO2具有漂白性
C. 该反应中FeSO4既作氧化剂又作还原剂
D. 该反应生成的气体通入足量BaCl2溶液中,可得到BaSO3和BaSO4两种沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素是生命的基础,自然界中氮的循环过程如下图所示,请分析此图并回答有关问题。

(1)大气中的氮以________(填化学式)形式存在,图中共表示了_______种固氮的途径。
(2)由图可知,动植物体内的氮主要存在于蛋白质中,当动植物尸体发生腐败时,往往会产生一种含氮的气体,其电子式为________。
(3)土壤中的硝酸盐会被细菌分解。有一种脱氧硫杆菌能够利用土壤中的硫化物来分解硝酸盐,其主要化学原理如下:K2S+KNO3+H2O![]() N2↑+K2SO4+KOH,配平上述反应方程式,并标出电子转移的方向和数目___________。上述反应的氧化剂是_____,被氧化的元素是______。
N2↑+K2SO4+KOH,配平上述反应方程式,并标出电子转移的方向和数目___________。上述反应的氧化剂是_____,被氧化的元素是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com