
【题目】数十年来,化学工作者对碳的氧化物和氢化物做了广泛深入的研究并取得了一些重要成果. 已知:C(s)+O2(g)=CO2(g);△H=﹣393kJmol﹣1
2CO (g)+O2(g)=2CO2(g);△H=﹣566kJmol﹣1
2H2(g)+O2(g)=2H2O(g);△H=﹣484kJmol﹣1
(1)工业上常采用将水蒸气喷到灼热的炭层上实现煤的气化(制得CO、H2),该反应的热化学方程式是 .
(2)上述煤气化过程中需向炭层交替喷入空气和水蒸气,喷入空气的目的是;该气化气可在加热和催化剂下合成液体燃料甲醇,该反应方程式为 .
(3)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到. 第一步:2CH3OH(g)═HCOOCH3(g)+2H2(g)△H>0
第二步:HCOOCH3(g)═CH3OH(g)+CO(g)△H>0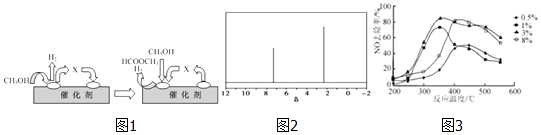
①第一步反应的机理可以用图1表示:图中中间产物X的结构简式为 .
②以甲醇制一氧化碳的反应为反应(填“吸热”、“放热”).
(4)天然气可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X.由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图2,则X的结构简式为 .
(5)C2H4可用于烟气脱硝.为研究温度、催化剂中Cu2+负载量对其NO去除率的影响,控制其他条件一定,实验结果如3图所示.为达到最高的NO去除率,应选择的反应温度和Cu2+负载量分别是 .
【答案】
(1)C(s)+H2O(g)═CO (g)+H2(g)△H=+132 kJ?mol﹣1
(2)让部分炭燃烧,提供炭与水蒸气反应所需要的热量; CO+2H2![]() CH3OH
CH3OH
(3)HCHO;吸热
(4)![]()
(5)350℃左右、3%
【解析】解:(1)已知:①C(s)+O2(g)=CO2(g);△H=﹣393kJmol﹣1
②2CO (g)+O2(g)=2CO2(g);△H=﹣566kJmol﹣1
③2H2(g)+O2(g)=2H2O(g);△H=﹣484kJmol﹣1
将(①×2﹣②﹣③)× ![]() 得到反应C(s)+H2O(g)=CO (g)+H2(g),则△H═(﹣393kJmol﹣1×2+566kJmol﹣1+484kJmol﹣1)×
得到反应C(s)+H2O(g)=CO (g)+H2(g),则△H═(﹣393kJmol﹣1×2+566kJmol﹣1+484kJmol﹣1)× ![]() =+132 kJmol﹣1
=+132 kJmol﹣1
所以答案是:C(s)+H2O(g)=CO(g)+H2(g)△H=+132 kJmol﹣1(2)根据(1)煤和水蒸气的反应生成一氧化碳和氢气要吸热,故喷入空气的目的是让部分炭燃烧,提供炭与水蒸气反应所需要的热量,
一氧化碳和氢气在一定条件下合成甲醇的原理为:CO+2H2![]() CH3OH,所以答案是:让部分炭燃烧,提供炭与水蒸气反应所需要的热量;CO+2H2
CH3OH,所以答案是:让部分炭燃烧,提供炭与水蒸气反应所需要的热量;CO+2H2![]() CH3OH(3)①依据图示和分解反应过程,结合原子守恒可知,甲醇去氢后得到的是甲醛,化学式为HCHO,
CH3OH(3)①依据图示和分解反应过程,结合原子守恒可知,甲醇去氢后得到的是甲醛,化学式为HCHO,
所以答案是:HCHO
②∵第一步:2CH3OH(g)═HCOOCH3(g)+2H2(g)△H>0
第二步:HCOOCH3(g)═CH3OH(g)+CO(g)△H>0
∴第一步+第二步得:CH3OH(g)═2H2(g)+CO(g)△H>0,故反应吸热,
所以答案是:吸热(4)芳香烃X的相对分子质量为l06,设其分子式为CxHy,由 ![]() =8…10=8…10,可知分子式为C8H10,分子中含有一个苯环,为苯的同系物,核磁共振氢谱中有2个峰,可知分子中含有2种环境的H,应含有2个甲基且处于对位位置,则X的结构简式为
=8…10=8…10,可知分子式为C8H10,分子中含有一个苯环,为苯的同系物,核磁共振氢谱中有2个峰,可知分子中含有2种环境的H,应含有2个甲基且处于对位位置,则X的结构简式为 ![]() ,
,
所以答案是: ![]() ;(5)满足脱硝率高,负载率低,适宜的温度,由图可知,适合条件为350℃左右,3%,
;(5)满足脱硝率高,负载率低,适宜的温度,由图可知,适合条件为350℃左右,3%,
所以答案是:350℃左右、3%
【考点精析】解答此题的关键在于理解反应热和焓变的相关知识,掌握在化学反应中放出或吸收的热量,通常叫反应热.


科目:高中化学 来源: 题型:
【题目】目前,世界上生产的镁有60%来自海水,其生产流程图如下:

(1)贝壳的主要化学成分为____________________(写化学式)。
(2)写出反应②的离子方程式_____________________________________。
(3)写出Mg与CO2反应的化学方程式__________________________________________。
(4)电解熔融氯化镁制取金属镁,若有0.4 mol电子发生转移,理论上能得到金属镁的质量是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是重要的化工原料,又可作为燃料.利用合成气(主要成分为![]() 、
、![]() 和
和![]() )在催化剂的作用下合成甲醇,发生的主要反应如下:
)在催化剂的作用下合成甲醇,发生的主要反应如下:
①![]()
②![]()
③![]()
回答下列问题:
化学键 |
|
| (CO)中的 |
|
|
|
|
|
|
|
|
(1)已知反应①中的相关的化学键键能数据如下:由此计算![]() ________
________ ![]() .
. ![]() ,已知
,已知![]() .
. ![]() ,则
,则![]() ________
________ ![]() .
. ![]()
(2)反应①的化学平衡常数![]() 的表达式为________;图
的表达式为________;图![]() 中能正确反映平衡常数
中能正确反映平衡常数![]() 随温度变化关系的曲线为________(填曲线标记字母),其判断理由是_____________________________.
随温度变化关系的曲线为________(填曲线标记字母),其判断理由是_____________________________.
(3)合成气的组成![]() 时体系中的
时体系中的![]() 平衡转化率
平衡转化率![]() 与温度和压强的关系如图
与温度和压强的关系如图![]() 所示.
所示. ![]() 值随温度升高而________(填“增大”或“减小”),其原因是_________________.图
值随温度升高而________(填“增大”或“减小”),其原因是_________________.图![]() 中的压强由大到小为________,其判断理由是____________________________________________
中的压强由大到小为________,其判断理由是____________________________________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,世界上生产的镁有60%来自海水,其生产流程图如下:
![]()
(1)贝壳的主要化学成分为____________(写化学式)。
(2)过滤后得到的沉淀和氯化铵溶液反应也可以得到氯化镁,产物没有气体,请写出离子方程式:____________________。
(3)根据流程图可知,可循环利用的物质是_____________。
(4)Mg在CO2中燃烧时,有白色粉末并有黑色固体生成.请写出Mg与CO2反应的化学方程式__________________。
(5)Na比Mg和Al要活泼,将Na投入到Fe2(SO4)3溶液中会发生剧烈的化学反应,其离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物![]() 是治疗高血压的药物“比索洛尔”的中间体,一种合成
是治疗高血压的药物“比索洛尔”的中间体,一种合成![]() 的路线如下:
的路线如下:

已知以下信息:
①![]() 的核磁共振氢谱为单峰;
的核磁共振氢谱为单峰; ![]() 的核磁共振氢谱为三组峰,峰面积比为
的核磁共振氢谱为三组峰,峰面积比为![]() .
.
②![]() 的苯环上仅有两种不同化学环境的氢;
的苯环上仅有两种不同化学环境的氢; ![]() 可与
可与![]() 或
或![]() 反应.
反应.
回答下列问题:
(1)![]() 的结构简式为______________________.
的结构简式为______________________.
(2)![]() 的化学名称为_______________________.
的化学名称为_______________________.
(3)![]() 与
与![]() 反应生成
反应生成![]() 的化学方程式为______________________________.
的化学方程式为______________________________.
(4)由![]() 生成
生成![]() 的反应类型为_________________________________.
的反应类型为_________________________________.
(5)![]() 的分子式为______________________________________.
的分子式为______________________________________.
(6)![]() 是
是![]() 的同分异构体,可与
的同分异构体,可与![]() 溶液发生显色反应,
溶液发生显色反应, ![]() 的
的![]() 可与
可与![]() 的
的![]() 反应,
反应, ![]() 共有________种;其中核磁共振氢谱为四组峰,峰面积比为
共有________种;其中核磁共振氢谱为四组峰,峰面积比为![]() 的结构简式为________、________.
的结构简式为________、________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是镁的主要来源之一.从海水中提取镁可按如下步骤进行:①把贝壳制成石灰乳;②向引入的海水中加入石灰乳,沉降、洗涤、过滤沉淀物;③将沉淀物与盐酸反应,结晶、过滤、干燥;④电解得到产物.
(1)以上提取镁的全过程中,没有涉及的化学反应类型是(填序号).
A.分解反应
B.化合反应
C.置换反应
D.复分解反应
(2)下列关于提取镁的说法中不正确的是(填序号).
A.此法的优点之一是原料来自大海
B.进行①②③步骤的目的是富集MgCl2
C.可用电解熔融氧化镁的方法制取镁
D.电解冶炼镁要消耗大量电能
(3)电解熔融氧化镁制取镁的化学反应方程式 .
(4)③中沉淀物与盐酸反应的离子反应方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,其中X、Y、W、Z为知周期元素,T的单质常温下为液体。下列说法错误的是

A. X、Y的单质均存在同素异形体
B. Y、Z的简单氢化物的稳定性依次递增
C. 工业上电解NaW溶液得W2可使用阴离子交换膜
D. R的单质可用于制造半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下:
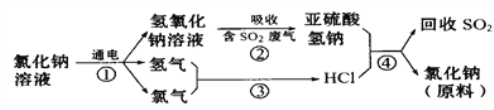
写出反应②的化学方程式______________________________。
(2)亚硫酸氢钠与甲醛经过一定反应,可以合成俗称“吊白块”的物质(该物质对人体有害),其结构简式为HOCH2SO3Na,根据其结构特点,可判断“吊白块”能发生的反应有________。
A.皂化反应 B.加聚反应 C.与金属钠反应 D.氧化反应
(3)近日,中科院大连化物所孙剑、葛庆杰研究员团队发现了二氧化碳高效转化新过程,通过设计一种新型多功能复合催化剂,首次实现了CO2 直接加氢制取高辛烷值汽油(用C5H12表示),试写出该反应的化学方程式____________________________________。
(4)煤的气化和液化属于______________(填“物理”或“化学”)变化。
(5)可燃冰属于新能源,我国是全球第一个成功稳定开采可燃冰的国家某种可燃冰(甲烷水合物)晶体中,平均每46个水分子构成8个分子笼,每个分子笼可容纳1个甲烷分子或1个水分子,若这8个分子笼中有6个容纳的是甲烷分子,另外2个被水分子填充,则这种可燃冰的平均组成可表示为____________
(6)海水中溴含量为65mg·L-1。若1L 海水中有95%的溴元素被氧化为Br2 经热空气吹出,溴单质残留量为3%。最后用SO2 将90%的Br2 还原成Br-,所得溶液体积为50mL,则所得溶液中溴离子浓度为原海水中溴离子浓度的_____________倍(计算结果精确到0.1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体内有多种微量元素,它们的含量很少,但是对人体的健康却起着重要作用。下列各元素全部是微量元素的是
A. Na K Cl S O B. Fe Zn Cu Mn C. H O C N P D. Cu Ca Mg C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com