
下列溶液中,微粒的物质的量浓度关系正确的是
A.某Na2CO3溶液中:c(OH-)+2c(CO32-)+c(HCO3-)=c(H+)+c(Na+)
B.常温时,将PH=1的醋酸和PH=13的NaOH溶液等体积混合后的溶液c(CH3COO-)>c(Na+)>c(H+) >c(OH-)
C.NaHCO3溶液中:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3)
D.0.1 mol·L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3·H2O)=0.2 mol
AB
【解析】
试题分析: A.由电荷守恒可知:Na2 CO3溶液中:c(OH-)+2c(CO32-)+c(H CO3-)=c(H+)+c(Na+),故A正确。B.常温时PH=1的醋酸物质的量浓度远大于PH=13的NaOH溶液,二者等体积混合后的溶液中,醋酸过量,溶液呈酸性。有c(H+)>c(OH-),根据电荷守恒,可知c(CH3COO-)>c(Na+),由于H+被中和,则溶液中c(Na+)>c(H+),所以有c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故D正确C.由物料守恒可知:NaHCO3溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),故C错误。D.由物质守恒可知:0.1 mol·L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3·H2O)=0.2 mol/L,故D错误。
考点:了解电离、电解质、强电解质和弱电解质的概念。并能表示弱电解质在水溶液中的电离平衡。了解溶液pH的定义,能进行溶液pH的简单计算。了解盐类水解的原理,能说明影响盐类水解的主要因素,


科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl-各1.5mol,Mg2+为0.5mol,则SO42-的物质的量是
A.0.25 mol B.0.5mol C.0.75mol D.0.75mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省等五校高三上学期第二次联考理综化学试卷(解析版) 题型:填空题
[化学—选修3:物质结构与性质](15分)
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。
请填写下列空白。
(1)E元素基态原子的核外电子排布式为_________________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为_____________(填元素符号),其原因为_____________________。
(3)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为__________;
1 mol B2A4分子中含__________molσ键。
(4)已知D、E能形成晶胞如图所示的两种化合物,

化合物的化学式,甲为__________,乙为_____________;高温时,甲易转化为乙的原因为__________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三第五次调研考试化学试卷(解析版) 题型:简答题
(14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用甲烷氧化法合成甲醇的反应有:
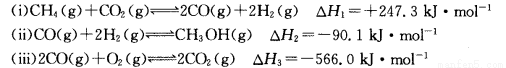
(1)用CH4和02直接制备甲醇蒸气的热化学方程式为 。
(2)某温度下,向4 L恒容密闭容器中通人6 mol C02和6mol CH4,发生反应(i),平衡体系中各组分的体积分数均为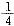 ,则此温度下该反应的平衡常数K= ,CH4的转化率为 。
,则此温度下该反应的平衡常数K= ,CH4的转化率为 。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
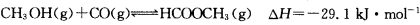 ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下:


①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 (填“3.5× 106 Pa” “4.O×106 Pa”或“5.0× 106 Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。
(4)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:

①通入a气体的电极是电池的 (填“正”或“负”)极,其电极反应式为 .
②常温下,用此电池以惰性电极电解O.5 L饱和食盐水(足量),若两极共生成气体1.12 L(已折算为标准状况下的体积),则电解后溶液的pH为 (忽略溶液的体积变化)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三第五次调研考试化学试卷(解析版) 题型:选择题
“富勒烯”家族又增添了新成员,继C60、C70、N60之后,中美科学家首次发现了全硼富勒烯B40。下列说法正确的是
A.B40和C70都属于新型化合物
B.C60和N60于同分异构体
C.B40、C60、N60、C70都只含共价键
D.B40、C60、N60、C70都属于烯烃
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省惠州市高三第三次调研考试化学试卷(解析版) 题型:选择题
用NA表示阿伏伽德罗常数的值。下列叙述正确的是:
A.常温常压下,22.4L CH4中含有4NA个C-H键
B.48g O3气体含有3NA个氧原子
C.在1L0 .5mol·L-lFeCl3溶液中含有0.5NA个Fe3+
D.标准状况下,2.24LCCl4含有的分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:选择题
近年来,科学家研制了一种新型的乙醇电池,它用酸性电解质(H+)作溶剂。电池总反应为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是
A.乙醇在电池的负极上参加反应
B.1mol CH3CH2OH被氧化转移6mol e-
C.随着反应的进行,正极附近的酸性减弱。
D.电池正极的正极反应为4H++O2+4e-=2H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列常见金属的冶炼原理中不合理的是
金属 | 冶炼原理 | |
A | Fe | Fe2O3+3CO= |
B | Hg | 2HgO |
C | Mg | 2MgO(熔融)= |
D | Na | 2NaCl(熔融)= |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三下学期初考理综化学试卷(解析版) 题型:选择题
某恒温密闭容器中,可逆反应A(s) B+C(g) ΔH= +Q kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B+C(g) ΔH= +Q kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
A.产物B的状态只能为固态或液态
B.平衡时,v(A)消耗﹕n(C)消耗=1﹕1
C.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
D.若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com