
【题目】CO2的有效利用可以缓解温室效应和能源短缺问题。
(1)CO2的结构式___________,所含化学键类型为__________(填“非极性键”或“极性键”或“离子键,下同)。
(2)中科院的科研人员在Na-Fe3O4和HMCM-22 的表面将CO2转化为烷烃,其过程如图。
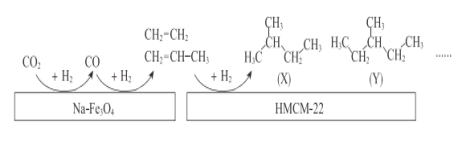
①Na-Fe3O4和HMCM-22 在反应中的作用为___________
②写出(X)的所有同分异构体结构简式___________
③关于X和Y的说法正确的是_______(填序号)。
A.最简式相同 B.都有4种一氯代物
C.都易使酸性KMnO4溶液褪色 D.X和Y互称同分异构体
(3)同温同压下,蒸气密度是氢气15倍的烷烃(M),写出烷烃(M)的结构简式____其与氯气反应生成一氯代烃的方程式________。
【答案】O=C=O 极性键 催化剂 CH3CH2CH2CH2CH3、C(CH3)4 B CH3CH3 CH3CH3 + Cl2![]() CH3CH2 Cl+ HCl
CH3CH2 Cl+ HCl
【解析】
(1)C原子上最外层有四个电子,能形成四对共用电子对,O原子最外层上有6个电子,能形成2对共用电子对,故CO2的结构式O=C=O,都是碳和氧原子之间形成的化学键,故类型为极性键,故答案为:O=C=O 极性键;
(2) ①从图中可以看出Na-Fe3O4和HMCM-22在反应过程中参与反应,但反应前后并没有变化,故其作用为做催化剂,故答案为:催化剂;
② X是异戊烷,其同分异构体有两种分别为正戊烷、新戊烷,结构简式分别为CH3CH2CH2CH2CH3、C(CH3)4,故答案为:CH3CH2CH2CH2CH3、C(CH3)4;
③A.X的分子式为C5H12和Y的分子式为C6H14,显然最简式不相同,故A错误;
B.根据X和Y的结构式可知,核磁共振氢谱有4种峰,它们都有4种一氯代物,故B正确;
C.X和Y都属于烷烃,不使酸性KMnO4溶液褪色,故C错误;
D.X的分子式为C5H12和Y的分子式为C6H14,结构相似,相差一个-CH2原子团,故X和Y互称同系物,故D错误;
故答案为:B;
(3)同温同压下,气体的密度之比等于其相对分子质量之比,蒸气密度是氢气15倍的烷烃(M),M的相对分子质量为15×2=30,又烷烃的组成通式为CnH2n+2,故烷烃(M)的分子式为C2H6,结构简式为CH3CH3,其与氯气反应生成一氯代烃的方程式为:CH3CH3 + Cl2![]() CH3CH2 Cl+ HCl,故答案为:CH3CH3CH3CH3 + Cl2
CH3CH2 Cl+ HCl,故答案为:CH3CH3CH3CH3 + Cl2![]() CH3CH2 Cl+ HCl。
CH3CH2 Cl+ HCl。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某温度时,在 2 L 的密闭容器中,X、Y、Z(均为气体)的物质的量随时间的变化曲线如图所示。请回答下列问题:

(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)反应从开始至2 min,用 Z 的浓度变化表示的平均反应速率 v(Z)=___________。
(3)_____min时, 反应达到平衡,容器内混合气体的平均相对分子质量比起始时_____(填“增大”“减小”或“不变”下同);混合气体的密度______。
(4)改变下列措施能加快反应速率的是_____(填序号,下同)。
A.恒压时充入He B.恒容时充入He C.恒容时充入X D.扩大容器体积 E.升高温度 F.选择高效的催化剂
(5)下列能作为判断反应达到平衡的依据的是_____。
A.体系压强不变 B. 2v(Z)正=3v(X)逆 C.三种气体的总质量不变 D.X 的转化率为 30%
(6)将 a mol X 与 b mol Y 的混合气体通入 2 L 的密闭容器中并发生上述反应,反应到某时刻各物质的物质的量恰好满足:n(X)=n(Y)=n(Z),则原混合气体中 a∶b=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铜、锌、稀硫酸构成的原电池中(如图所示)。
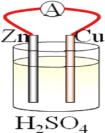
(1)负极是__(填“铜”或“锌”),__电子(填“失去”或“得到”),发生__反应(填“氧化”或“还原”),电极反应方程式___;正极是__(填“铜”或“锌”)__电子(填“失去”或“得到”),发生__反应(填“氧化”或“还原”),电极反应方程式__。
(2)电流由___流向___(填“铜”或“锌),铜片上观察到的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯磺酸是无色液体,密度1.79g·cm-3,沸点约152℃。氯磺酸有强腐蚀性,遇湿空气产生强烈的白雾,故属于危险品。制取氯磺酸的典型反应是在常温下进行的,反应为 HCl(g)+SO3 = HSO3Cl。实验室里制取氯磺酸可用下列仪器装置(图中夹持、固定仪器等已略去),实验所用的试剂、药品有:①密度1.19g·cm-3浓盐酸 ②密度1.84g·cm-3、质量分数为98.3%的浓硫酸 ③发烟硫酸(H2SO4··SO3) ④无水氯化钙 ⑤水。制备时要在常温下使干燥的氯化氢气体和三氧化硫反应,至不再吸收HCl时表示氯磺酸已大量制得,再在干燥HCl气氛中分离出氯磺酸。
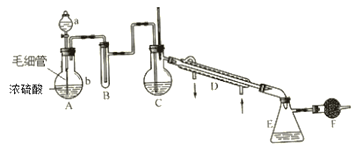
(1)仪器中应盛入的试剂与药品(填数字序号):A中的a____ B____ C_____ F_____ 。
(2)A的分液漏斗下边接有的毛细管是重要部件,在发生气体前要把它灌满a中液体,在发生气体时要不断地均匀放出液体。这是因为______________________________________。
(3)实验过程中需要加热的装置是___________________ (填装置字母)。
(4)若不加F装置,可能发生的现象是________________________________________, 有关反应的化学方程式______________________________________________________。
(5)在F之后还应加的装置是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量的CO2不断通入NaOH、Ca(OH)2、NaAlO2的混合溶液中,则生成沉淀的物质的量与通入CO2的体积的关系可表示为( )
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为 ,分析其结构,并回答下列问题:
,分析其结构,并回答下列问题:
(1)写出其分子式:____________________________________________。
(2)其中含有____个不饱和碳原子,分子中有____个双键。
(3)分子中的极性键有__________(写出2种即可)。
(4)分子中的饱和碳原子有______个,一定与苯环处于同一平面的碳原子有______个。
(5)分子中C—C===O键角约为__________,H—C≡C键角约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势如下图所示:
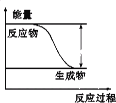
(1)该反应为_______反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是_______(填字母)
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度 D.减小压强
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为_________极(填“正”或“负”)。铜片上产生的现象为_________,外电路中电子由________电极(填“Fe”或“Cu”,下同),向________电极移动。
(4)若依据氧化还原反应:Cu2++Fe=Cu+Fe2+设计的原电池如下图所示,请回答下列问题:
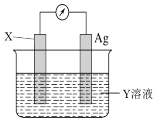
电极X的材料是________,电解质溶液Y是_________,X电极上发生的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一有机化学基础](13分)
对二甲苯(英文名称p-xylene,缩写为PX)是化学工业的重要原料。
(1)写出PX的结构简式 。
(2)PX 可发生的反应有 、 (填反应类型)。
(3)增塑剂(DEHP)存在如下图所示的转化关系,其中A 是PX的一种同分异构体。

① B 的苯环上存在2 种不同化学环境的氢原子,则B 的结构简式是 。
② D 分子所含官能团是 (填名称)。
③ C 分子有1个碳原子连接乙基和正丁基,DEHP的结构简式是
(4)F 是B 的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物;b.遇FeCl3溶液显示特征颜色;c.能与碳酸氢钠溶液反应。
写出F 与NaHCO3溶液反应的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员利用锂离子在石墨烯表面和电极之间能做快速大量穿梭运动的特性,开发出一种新能源电池——石墨烯电池(如图所示),该电池用嵌有锂单质的石墨烯(用LixC6表示)和钴酸锂作电极材料,总反应式为LixC6+Li1-xCoO2![]() LiCoO2+C6,下列关于该电池的说法中错误的是( )
LiCoO2+C6,下列关于该电池的说法中错误的是( )
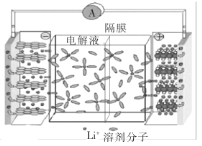
A.钴酸锂作正极材料
B.该隔膜应为阴离子交换膜
C.正极的电极反应式为Li1-xCoO2+xLi++xe-=LiCoO2
D.该电池的优点是提高电池的储锂容量进而提高能量密度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com