
【题目】如图是恒温条件下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是

A. 反应达到平衡时,正反应速率和逆反应速率相等
B. 该反应达到平衡状态Ⅰ后,增大体系压强,平衡发生移动,达到平衡状态Ⅱ
C. 该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ
D. 同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】溴及其化合物广泛用于医药、塑料阻燃剂等,苦卤提溴的工业流程如下:
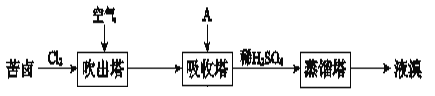
(1)Cl2和苦卤中的Br﹣反应生成Br2的离子方程式是_____。
(2)结合元素周期律解释Cl的非金属性强于Br的原因:_____。
(3)吸收塔中,A吸收了Br2后的溶液中含有Br﹣和BrO3﹣,则A是_____(填序号)。
a.NaCl溶液 b.Na2CO3溶液 c.SO2气体
(4)从吸收塔出来的溶液中加入稀H2SO4得到Br2的离子方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验及现象能推出相应结论的是
选项 | 实验操作 | 现象 | 结论 |
A | 向苯酚钠溶液中加入NaHSO3溶液 | 溶液变浑浊 | 酸性:H2SO3>苯酚 |
B | 向KI淀粉溶液中滴入无色溶液X | 溶液变蓝色 | X一定为H2O2溶液 |
C | 将3体积SO2与1体积O2混合并通过灼热的催化剂充分反应,产物依次通过BaCl2溶液和品红溶液 | 前者产生白色沉淀,后者溶液褪色 | SO2与O2的反应为可逆反应 |
D | 向2支均盛有2mL1.0mol·L-1的KOH溶液的试管中,分别加入2滴浓度均为0.1mol·L-1的AlCl3和FeCl3溶液 | 一支试管出现红褐色沉淀,另一支无明显现象 | Ksp[Al(OH)3]> Ksp[Fe(OH)3] |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气压强对许多物理实验和化学实验有着重要影响,制取氨气并完成喷泉实验。
图1 图2
图2
(1)检验圆底烧瓶中氨气收集满的方法是_________________________________。
(2)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是________,该实验的原理是________________________________________。
(3)如果只提供如图2的装置,请说明引发喷泉的方法:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 因为晶体硅有熔点高硬度大的性质,所以被用来做芯片
B. 工业上用焦炭在电炉中还原二氧化硅得到含有少量杂质的硅
C. 合金熔点、硬度都低于成分金属,钢是用量最大用途最广的合金
D. 工业生产玻璃、水泥都需要用到的原材料是石英砂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(选做题)本题包括A、B两小题。请选定其中一个小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]
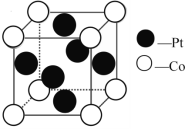
钴的合金及其配合物用途非常广泛。
(1)Co3+基态核外电子排布式为_____。
(2)一种Pt、Co金属间化合物可作为质子交换膜燃料电池的催化剂,其晶胞结构如图所示,该金属间化合物的化学式为_____。
(3)BNCP可用于激光起爆器等,BNCP可由HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为_____(用文字描述)。
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co(Ⅲ)形成配位键的原子是_____(已知CO32—的结构式为:![]() )。
)。
③NaNT可由![]() (双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为_____,1mol该分子中含
(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为_____,1mol该分子中含![]() 键的数目为_____。
键的数目为_____。
B.[实验化学]
EDTA(乙二胺四乙酸)是螯合剂的代表物(沸点为116~117.2℃),可用于制备EDTAFeNa·3H2O等。实验室制备EDTA的实验步骤如下:
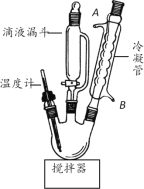
步骤1:在三口烧瓶中加入22.5gClCH2COOH、45mLH2O搅拌至溶解;在不断搅拌下,将含22gNaOH、60mLH2O、6.6g H2NCH2CH2NH2的盐酸盐所配成的溶液,从滴液漏斗中不断滴加到三口烧瓶中。
步骤2:加料完毕后,升温到102~106℃并保温,调节并保持 pH约为9,搅拌2h。
步骤3:加入活性炭,搅拌、静置、过滤。
步骤4:滤液用盐酸酸化至pH=1,放置、结晶、过滤、洗涤、干燥,制得EDTA。
(1)图中冷凝管装置的作用是_____,水从接口_____(填标号)通入。
(2)步骤3中加入活性炭的目的是_____;测定溶液pH的方法是_____。
(3)步骤4中“洗涤”时,能说明已洗涤完全的方法是_____。
(4)请补充完整由EDTA、NaHCO3、FeCl3·6H2O为原料制备EDTAFeNa·3H2O的实验方案(已知EDTANa4+FeCl3![]() EDTAFeNa + 3NaCl):向250mL烧杯中依次加入160mL蒸馏水、23gEDTA,搅拌至完全溶解,_____,再分次加入21.6g FeCl3·6H2O,保温20min,调pH小于5,冷却、抽滤、洗涤、干燥得EDTAFeNa·3H2O(实验中须使用的试剂为:NaHCO3,用量为26.8g)。
EDTAFeNa + 3NaCl):向250mL烧杯中依次加入160mL蒸馏水、23gEDTA,搅拌至完全溶解,_____,再分次加入21.6g FeCl3·6H2O,保温20min,调pH小于5,冷却、抽滤、洗涤、干燥得EDTAFeNa·3H2O(实验中须使用的试剂为:NaHCO3,用量为26.8g)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯为原料合成一些化工产品的转化关系如下:

回答下列问题:
(1)A的名称是_________。
(2)C的结构简式为__________。
(3)B→D的反应类型是______;E中所含官能团名称是______。
(4)B→A的化学方程式为_________。
(5)写出E发生加聚反应方裎式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有CaCl2、MgCl2、Na2SO4以及泥沙等杂质,以下是实验室制备精盐的实验方案:

(1)实验方案中②③④步通常采用以下三种试剂,a:Na2CO3溶液;b:BaCl2溶液;c:NaOH溶液,加入试剂不合理的顺序是(_____)
A.c b a
B.b c a
C.b a c
D.c a b
(2)如图是中学化学中常用于混合物的分离和提纯的装置,该实验方案中:

(1)在第⑤步操作中要用到的装置是图中的___(填字母),玻璃棒的作用是___;
(2)第⑦步操作的名称是___,所用到的实验装置是上图中的___(填字母),其中用于盛放溶液的仪器名称是___;
(3)检验SO42-是否除尽的操作方法是________;
(4)为提高精盐的产率,第⑤步操作后应对沉淀加以洗涤,请简要描述洗涤的方法是:___;
(5)写出第⑥步可能发生的化学反应方程式:_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com