
| A. | Na+ 1s22s22p63s2 | B. | F 1s22s22p5 | ||
| C. | O2- 1s22s22p6 | D. | Ar 1s22s22p63s23p6 |
分析 原子或离子的电子排布应符合能量最低原理,一般来说离子的核外最外层达到8电子稳定结构,根据构造原理,s能级最多可容纳2个电子,p能级有3个轨道最多可容纳6个电子,电子总是优先从能量低的能层、能级排列,以此判断.
解答 解:A.Na的原子序数为11,离子的核外电子排布式为1s22s22p6,最外层达到8电子稳定结构,故A错误;
B.F原子核外有9个电子,核外电子排布式为1s22s22p5,故B正确;
C.O的原子序数为8,离子的核外电子排布式为1s22s22p6,最外层应达到8电子稳定结构,故C正确;
D.Ar的核外有18个电子,核外电子排布式为1s22s22p63s23p6,符合能量最低原理,故D正确.
故选A.
点评 本题考查的是构造原理及各能级最多容纳的电子数,题目难度不大,注意把握原子核外电子排布规律.


 同步轻松练习系列答案
同步轻松练习系列答案科目:高中化学 来源: 题型:解答题
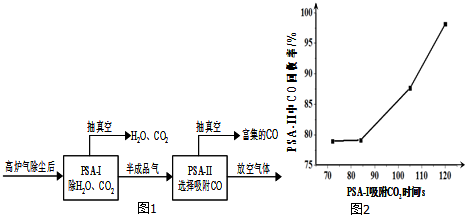
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NA个NO2、N2O4分子的混合气体降低温度,混合气体的分子数目小于NA | |
| B. | 常温常压和光照条件下,33.6 LCl2与3.0g H2反应,生成的HCl分子数目为3NA | |
| C. | 1.68 g Fe和足量水蒸气反应,转移的电子数目为0.09NA | |
| D. | 一定条件下,1 mol N2和3 mol H2充分反应,生成物中含N-H键数目为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
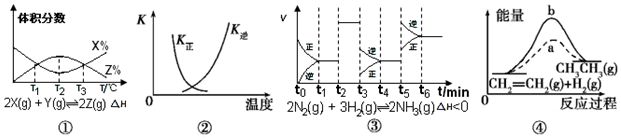
| A. | 由图①知,反应在T1、T3处达到平衡,且该反应的△H<0 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g),△H<0正、逆反应的平衡常数K随温度的变化 | |
| C. | 由图③知,反应在t6时,NH3体积分数最大,t3时采取降低反应温度的措施 | |
| D. | 图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1=2Q2=92.4 | B. | Ql>2Q2 | C. | Q1<2Q2 | D. | Q1=2Q2>92.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
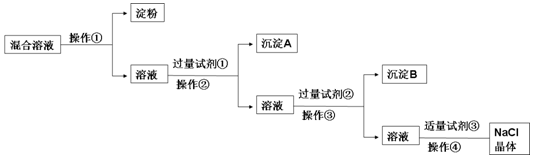
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe+CuSO4═FeSO4+Cu | B. | 3CO+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 | ||
| C. | AgNO3+NaCl═AgCl↓+NaNO3 | D. | 2KMnO4 $\frac{\underline{\;\;△\;\;}}{\;}$ K2MnO4+MnO2+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 生成42.0 L N2(标准状况) | |
| B. | 转移电子的物质的量为1.25 mol | |
| C. | 有0.250 mol KNO3被氧化 | |
| D. | 被氧化的N原子的物质的量为3.75 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com