
【题目】海水中溴元素以Br﹣形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下图:

请回答下列问题.
(1)将海水浓缩的方法是__;
(2)步骤①反应的离子方程式是__,1molCl2参加反应,转移电子__mol;
(3)步骤②通入热空气吹出Br2,利用了Br2的__(填序号);
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(4)步骤③中用SO2的水溶液吸收Br2,吸收率可达95%,该反应的氧化剂是__,在工业生产中此步骤应解决的问题是__.
【答案】 蒸发 Cl2+2Br﹣=2Cl﹣+Br2 2 C Br2 吸收尾气,防止污染空气
【解析】海水蒸发浓缩酸化得到浓缩海水通入氯气氧化溴离子得到含溴单质的混合溶液,利用热空气吹出Br2,被二氧化硫吸收得到含HBr的混合溶液,通入氯气氧化得到溴单质,富集溴元素得到含Br2的混合溶液Ⅱ,蒸馏得到溴单质,则
(1)海水通过蒸发浓缩得到浓缩海水,将海水浓缩的方法是蒸发;(2)步骤①是氯气氧化溴离子得到溴单质,反应的离子方程式是Cl2+2Br-=2Cl-+Br2,依据元素化合价变化计算1molCl2参加反应,转移电子物质的量为2mol;(3)通入热空气吹出Br2,利用了Br2的挥发性,故选C;(4)用SO2的水溶液吸收Br2,氧化剂为溴单质,二氧化硫和溴蒸气有毒不能排放到空气中,应进行尾气吸收。


科目:高中化学 来源: 题型:
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g)![]() 2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
A. 平衡常数K值越大,X的转化率越大
B. 达到平衡时,反应速率v正(X)=2v逆(Z)
C. 达到平衡后,降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D. 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铝的熔点很高,常用于制造耐火材料,例如制作耐火坩埚。下列操作不能在氧化铝坩埚中进行的是( )
A. 加热使CuSO4·5H2O失水 B. 加热使KMnO4分解
C. 加热熔化烧碱 D. 加热分解碱式碳酸铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,正确的是
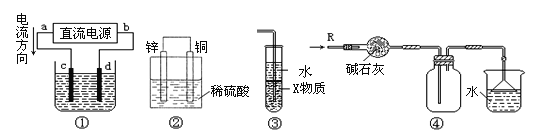
A. 若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
B. 装置②是原电池,能将化学能转化为电能,锌电极发生还原反应
C. 装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D. 装置④可用于收集氨气,并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下列实验方法操作,能达到要求的是
A. 用托盘天平称量25.20g氯化钠固体
B. 实验室制取蒸馏水时,圆底烧瓶中加些碎瓷片防止暴沸
C. 将4gNaOH固体倒入盛有1L水烧杯中配置成0.1mol/L烧碱溶液
D. 将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化学反应种类比较多,常见的有:①卤代反应 ②烯烃水化反应 ③氧化反应④还原反应 ⑤硝化反应 ⑥水解反应 ⑦酯化反应 ⑧消去反应 ⑨加聚反应⑩缩聚反应等等.其中属于取代反应的是( )
A.①⑤⑥⑦
B.②③④⑧⑨⑩
C.①②⑤⑥⑦
D.①⑤⑥⑦⑨⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 苯酚钠的溶液中通入少量CO2:2C6H5O-+CO2+H2O![]() 2C6H5OH+CO32-
2C6H5OH+CO32-
B. NaOH溶液中加入少量苯酚:C6H5OH+OH-![]() C6H5O-+H2O
C6H5O-+H2O
C. 银氨溶液中加入少量乙醛溶液,水浴加热:CH3CHO+2[Ag(NH3)2]++2OH-![]() CH3COONH4+2Ag↓+H2O+3NH3
CH3COONH4+2Ag↓+H2O+3NH3
D. 乙酸钠溶液加入少量盐酸:CH3COONa+H+![]() CH3COOH+Na+
CH3COOH+Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com