
【题目】将久置在空气中的锌粒投人稀硫酸中,测得锌粒和硫酸反应产生氢气的速率v(H2)与反应时间t的关系曲线如图所示。下列推论不正确的是( )

A.O→a段由于是锌粒表面的氧化物与酸的反应,所以未产生气体
B.b→c段产生氢气的速率增大较快的主要原因是温度升高
C.c时刻反应生成的H2的量最多
D.c时刻之后产生氢气的速率减小的主要原因是溶液中c(H+ )减小
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】冶金厂的炉渣中主要成分为CuO、Cu、Ag、Bi、Pb,还含有少量的SiO2和Au,从炉渣中回收有价金属的一种工艺流程如图所示。

回答下列问题:
(1)氧化浸取时加入H2O2的目的是__________________________(只要回答出一点即可)。
(2)熔炼时加入Na2CO3的目的是除硅,该过程的化学方程式是_____________________________。
(3)加入NaOH溶液的目的是调节溶液的pH,水解时通入水蒸气的目的是_______________________。
(4)流程中加入N2H4·H2O还原得到银的化学方程式是_____________________________。
(5)沉银和铅时,已知Ksp(AgCl)=1.8×10-10,Ksp(PbCl2)=1.8×10-5,当AgCl和PbCl2共沉且c(Pb2+)∶c(Ag+)=107时,溶液中的c(Cl-)=________mol·L-1。
(6)用流程中得到的铅制取Pb(NO3)2。用石墨作电极,电解Pb(NO3)2和Cu(NO3)2的混合溶液制取PbO2,阳极发生的电极反应式是_______________________,若电解液中不加入Cu(NO3)2,阴极反应式是______________________,这样做的主要缺点是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1 L0.1 mol·L-1 NH4C1溶液中,逐渐加入NaOH固体粉末,随着n(NaOH)的变化,c(NH4+)与c(NH3·H2O)的变化趋势如下图所示(不考虑体积变化、氨的挥发、温度的变化)。下列说法正确的是( )

A. M点溶液中水的电离程度比原溶液大
B. 在M点时,n(OH-)+0.1 mol=(a+0.05)mol
C. 随着NaOH的加入,c(H+)/c(NH4+)不断减小
D. 当n(NaOH)=0.1 mol时,c(Na+)<c(NH4+)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学可以变废为室,利用电解法处理烟道气中的NO,将其转化为NH4NO3的原理如下图所示,下列说法错误的是
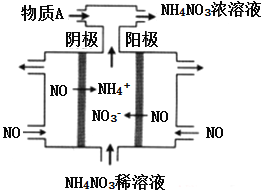
A. 该电解池的阳极反反为:NO-3e-+2H2O=NO3-+4H+
B. 该电解池的电极材料为多孔石墨,目的是提高NO的利用率和加快反应速率
C. 用NH4NO3的稀溶液代替水可以增强导电能力,有利于电解的顺利进行
D. 为使电解产物全部转化为NH4NO3,需补充物质A为HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产和生命活动中起着重要作用。
(1)氨气是一种重要的化工原料,氨态氮肥是常用的肥料。
哈伯法合成氨技术的相关反应为:N2(g)+3H2(g)![]() 2NH3(g) △H=-93kJ/mol,实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8。
2NH3(g) △H=-93kJ/mol,实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8。
①合成氨技术是氮的固定的一种,属于______(选填“大气固氮”、“生物固氮”“人工固氮”)。
②合成氨反应常用铁触媒催化剂,下列关于催化剂的说法不正确的是_________。
A.可以加快反应速率 B.可以改变反应热
C.可以减少反应中的能耗 D.可以增加活化分子的数目
③关于合成氨工艺的下列理解,正确的是_________。
A.原料气中N2过量,是因N2相对易得,适度过量有利于提高H2的转化率
B.控制温度(773K)远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
(2)肼(N2H4)是氮的氢化物之一,其制备方法可用次氯酸钠氧化过量的氨气。
①次氯酸钠溶液显碱性,表示原理的离子方程式是_________________________。
②常温下,该水解反应的平衡常数为K=1.0×10-6mol/L,则1.0mol/LNaClO溶液的pH=____。
③肼与N2O4氧化反应生成N2和水蒸气。
已知:N2(g)+2O2(g)=N2O4(l) △H=-19.5kJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-534.2kJ/mol
请写出肼和N2O4反应的热化学反应方程式_________________________________。
(3)在NH4HCO3溶液中,反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7)。
NH3·H2O+H2CO3的平衡常数K=_____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 100g质量分数为 46%C2H5OH溶液中所含O—H数目约为7NA
B. 质量为12g的12C含有的中子数为12NA
C. 将0.1molCH3COONa溶于稀醋酸中使溶液呈中性,溶液中CH3COO-数目小于0.1NA
D. 氢氧燃料电池正极消耗22.4 L气体时,电路中通过的电子数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,回答下列问题:
(1)写出下列物质的电子式。
Ca2+:____________
NaOH:____________
(2)写出下列物质的结构式。
N2:__________________
CH4:___________________
(3)用电子式表示HCl的形成过程:______
(4)现有下列物质①Na2SO4②CO2③HF ④Na2S ⑤C60 ⑥石墨烯,其中属于共价化合物的是___________(填序号,下同);属于离子化合物的是 _______________;属于同素异形体的是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素硼和镁对植物的叶的生长和人体骨骼的健康有着十分重要的作用,其化合物也应用广泛。
(1)基态B原子的电子排布图为________________________,其第一电离能比Be___________(填“大”或“小”)。
(2)三价B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构简式为___________ (标出配位键),其中心原子的杂化方式为________,写出[BH4]-的一种阳离子等电子体_______。
(3)下图表示多硼酸根的一种无限长的链式结构,其化学式可表示为____________(以n表示硼原子的个数)。

(4)硼酸晶体是片层结构,下图表示的是其中一层的结构。每一层内存在的作用力有_________。

(5)三氯化硼的熔点比氯化镁的熔点低,原因是_______________________。
(6)镁单质晶体中原子的堆积模型如下图,它的堆积模型名称为_______;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2a cm3,镁单质的密度为ρ g·cm-3,已知阿伏伽德罗常数为NA,则镁的摩尔质量的计算式是________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氢大麻酚(简称THC),是大麻中的主要精神活性物质,其结构如图。下列有关THC的说法不正确的是

A. THC难溶于水
B. 1mol THC最多可与含3mol溴单质的溴水发生反应
C. THC遇FeCl3溶液能发生显色反应
D. THC能与氢氧化钠溶液、碳酸钠溶液及碳酸氢钠溶液发生化学反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com