
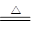 2MgO+MgS(或写成2Mg+SO2
2MgO+MgS(或写成2Mg+SO2 2MgO+S、Mg+S
2MgO+S、Mg+S MgS)
MgS)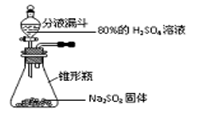
 2MgO+Si
2MgO+Si Mg2Si,硅化镁与稀硫酸反应生成:Mg2Si+2H2SO4=MgSO4+SiH4↑,SiH4自燃:SiH4+2O2=SiO2+2H2O
Mg2Si,硅化镁与稀硫酸反应生成:Mg2Si+2H2SO4=MgSO4+SiH4↑,SiH4自燃:SiH4+2O2=SiO2+2H2O 2MgO+Si
2MgO+Si Mg2Si Mg2Si+2H2SO4=MgSO4+SiH4↑ SiH4+2O2=SiO2+2H2O
Mg2Si Mg2Si+2H2SO4=MgSO4+SiH4↑ SiH4+2O2=SiO2+2H2O

科目:高中化学 来源:不详 题型:单选题
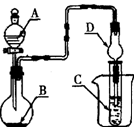
| A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 |
| B.若A为稀盐酸,B为石灰石,C中盛CaCl2溶液,则C中溶液变浑浊 |
| C.若A为浓氨水,B为生石灰,C中盛A1C13溶液,则C中先产生白色沉淀后沉淀又溶解 |
| D.若A为浓硝酸,B为铜屑,C中盛紫色石蕊溶液,则C中溶液变红色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 变红,又集得能使带火星的木条复燃的气体0.28L(标况下)。
变红,又集得能使带火星的木条复燃的气体0.28L(标况下)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
对某品牌牙膏中摩擦剂成分及其含量进行以下探究: __________________________________________。
__________________________________________。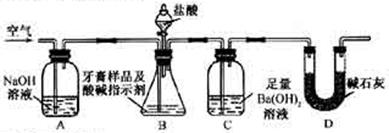
 ___。
___。 酸钙的质量分数为__________。
酸钙的质量分数为__________。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验编号 | 金属材料 | 溶 液 | 实验目的 |
| ① | 铝合金 | CO2+ H2O | Ⅰ.探究不同溶液对金属材料的腐蚀速率; Ⅱ.探究不同金属材料的腐蚀速率; |
| ② | | | |
| ③ | | |
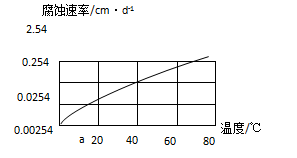
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
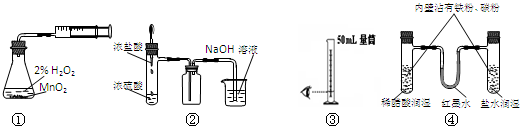
| A.装置①测定化学反应速率 | B.装置②制取并吸收HCl |
| C.装置③量取8.5mL的稀硫酸 | D.装置④模拟铁的腐蚀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
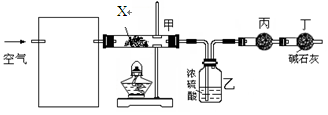
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com