
分析 依据实验过程中的现象分析判断,
(1)将部分粉末加入水中,振荡,有白色沉淀生成,说明含有能生成白色沉淀的物质,白色沉淀可以是碳酸钡或碳酸钙;
(2)向(1)的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生;证明沉淀一定是碳酸钙或碳酸钡沉淀;
(3)取少量(2)的溶液商入AgNO3溶液,有白色沉淀生成.证明含有氯离子,混合物中一定含有氯化钙,说明一定含有Ba(NO3)2、CaCl2;可能含有K2CO3.
解答 解:(1)将部分粉末加入水中,振荡,有白色沉淀生成,说明含有能生成白色沉淀的物质,白色沉淀可以是碳酸钡或碳酸钙;
(2)向(1)的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生;证明沉淀一定是碳酸钙或碳酸钡沉淀;
(3)取少量(2)的溶液商入AgNO3溶液,有白色沉淀生成.证明含有氯离子,混合物中一定含有氯化钙,说明一定含有K2CO3、CaCl2;可能含有Ba(NO3)2;
根据上述实验现象,判断白色粉末中肯定含有K2CO3、CaCl2;可能含有Ba(NO3)2,步骤(3)中发生反应的离子方程式:Ag++Cl-=AgCl↓.
故答案为:CaCl2、K2CO3;Ba(NO3)2;Ag++Cl-=AgCl↓.
点评 本题考查了常见离子的性质应用和鉴别,抓住离子特征性质是解答本题的关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | △H<0,△S>0所有温度下反应能自发进行 | |
| B. | 化合反应都是放热反应,分解反应都是吸热反应 | |
| C. | 凡是放热反应都是自发的,吸热反应都是非自发性的 | |
| D. | 自发反应一定不需要任何条件就容易发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 欲配制250mL0.1mol/L的NaOH溶液,回答下列有关问题.
欲配制250mL0.1mol/L的NaOH溶液,回答下列有关问题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
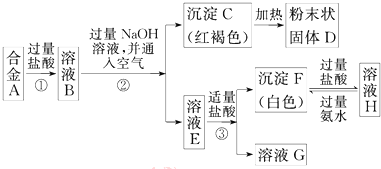
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液中滴入石蕊试液后溶液呈蓝色,证明该溶液一定是碱的溶液 | |
| B. | 向某无色溶液中滴入硝酸银溶液产生白色沉淀,证明该溶液一定是盐酸 | |
| C. | 某白色固体与熟石灰混合研磨后产生有刺激性的氨味,证明该固体是铵盐 | |
| D. | 向某固体中加入稀盐酸产生气泡,证明该固体一定是碳酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质分子中均存在化学键 | |
| B. | 含有共价键的化合物不一定是共价化合物 | |
| C. | 阴阳离子间通过静电引力而形成的化学键叫做离子键 | |
| D. | 只有金属元素和非金属元素化合时才能形成离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
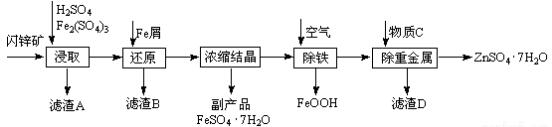
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com