
【题目】镍及其化合物用途广泛。某矿渣的主要成分是![]() (铁酸镍)、NiO、FeO、CaO、
(铁酸镍)、NiO、FeO、CaO、![]() 等,以下是从该矿渣中回收
等,以下是从该矿渣中回收![]() 的工艺路线:
的工艺路线:
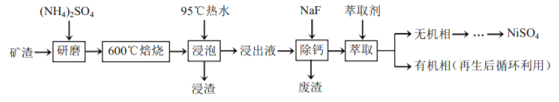
已知:![]() 在350℃以上会分解生成
在350℃以上会分解生成![]() 和
和![]() 。
。![]() 在焙烧过程中生成
在焙烧过程中生成![]() 、
、![]() 。锡(Sn)位于第五周期第ⅣA族。
。锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与![]() 混合研磨,混合研磨的目的是________。
混合研磨,混合研磨的目的是________。
(2)“浸泡”过程中![]() 生成
生成![]() 的离子方程式为________,“浸渣”的成分除
的离子方程式为________,“浸渣”的成分除![]() 、
、![]() 外还含有________(填化学式)。
外还含有________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入![]() 将
将![]() 还原为
还原为![]() ,所需
,所需![]() 的物质的量不少于
的物质的量不少于![]() 物质的量的________倍;除去过量的
物质的量的________倍;除去过量的![]() 后,再用酸性
后,再用酸性![]() 标准溶液滴定溶液中的
标准溶液滴定溶液中的![]() ,还原产物为
,还原产物为![]() ,滴定时反应的离子方程式为________。
,滴定时反应的离子方程式为________。
(4)“浸出液”中![]() ,当除钙率达到99%时,溶液中
,当除钙率达到99%时,溶液中![]() ________
________![]() [已知
[已知![]() ]
]
(5)本工艺中,萃取剂与溶液的体积比(![]() 对溶液中
对溶液中![]() 、
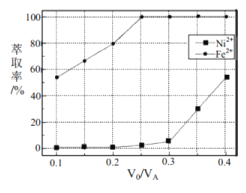
、![]() 的萃取率影响如图所示,
的萃取率影响如图所示,![]() 的最佳取值是________。
的最佳取值是________。
【答案】增大接触面积,加快反应速率,使反应更充分 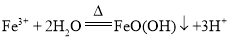
![]() 、
、![]() 0.5
0.5 
![]() 0.25
0.25
【解析】
某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,加入硫酸铵研磨后,600°C焙烧,已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3,在90°C的热水中浸泡过滤得到浸出液,加入NaF除去钙离子,过滤得到滤液加入萃取剂得到无机相和有机相,无机相通过一系列操作得到硫酸镍,有机相循环使用。
(1)混合研磨增大接触面积,加快反应速率;
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的反应为水解反应,矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,加入硫酸铵在600°C焙烧,然后热水浸泡,浸取后的浸渣为FeO(OH)、焙烧是生成的Fe2O3以及微溶于水的硫酸钙和不溶于水的二氧化硅;
(3)用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,依据氧化还原反应定量关系计算得到SnCl2的物质的量不少于Fe3+物质的量的倍数,用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,亚铁离子被氧化为铁离子;
(4)浸出液”中c(Ca2+)=1.0×10-3molL-1,当除钙率达到99%时,剩余钙离子1%×1.0×10-3mol/L=1.0×10-5mol/L,结合溶度积常数计算得到溶液中c(F-);
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图2所示,最佳取值是镍离子不能被萃取,亚铁离子被萃取,据此选择。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是增大接触面积,加快反应速率,使反应更充分,故答案为增大接触面积,加快反应速率,使反应更充分;
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为: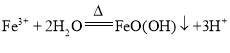 ,浸渣”的成分除Fe2O3、FeO(OH)外还含有 SiO2、CaSO4,故答案为
,浸渣”的成分除Fe2O3、FeO(OH)外还含有 SiO2、CaSO4,故答案为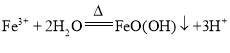 ; SiO2、CaSO4;
; SiO2、CaSO4;
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,反应为:2Fe3++Sn2+=Sn4++2Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的一半,为0.5倍,用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为:Cr2O27+6Fe2++14H+=2Cr3++6Fe3++7H2O,故答案为0.5; Cr2O27+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(4)浸出液”中c(Ca2+)=1.0×103molL1,当除钙率达到99%时,剩余钙离子1%×1.0×10-3mol/L=1.0×10-5mol/L,溶液中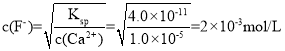 ,故答案为2.0×103;
,故答案为2.0×103;
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图2所示,最佳取值是镍离子不能被萃取,亚铁离子被萃取,V0/VA的最佳取值是0.25,故答案为0.25。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定量的铁粉和9克硫粉混合加热,待其反应后再加入过量盐酸,将生成的气体完全燃烧,共收集得9克水,则加入的铁粉质量为
A.14gB.42gC.56gD.28g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应X2(g)+Y2(g)![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
A. Z为0.2 mol·L-1 B. Y2为0.35 mol·L-1
C. X2为0.3 mol·L-1 D. Z为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物有许多用途。回答下列问题:
(1)基态![]() 原子的电子排布式为________,锰的第三电离能比铁的第三电离能大,这是因为________________________________________________________。
原子的电子排布式为________,锰的第三电离能比铁的第三电离能大,这是因为________________________________________________________。
(2)![]() 的沸点(71℃)比
的沸点(71℃)比![]() 的沸点(25.7℃)高,主要原因是______________________。
的沸点(25.7℃)高,主要原因是______________________。
(3)根据价层电子对互斥理论,![]() 、
、![]() 、
、![]() 三种微粒中,中心原子价层电子对数不同于其他微粒的是_______。
三种微粒中,中心原子价层电子对数不同于其他微粒的是_______。
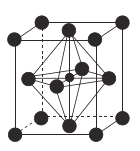
(4)![]() (氮化锰)的晶胞结构如图所示,晶胞参数为0.3851nm。该氮化锰的密度为
(氮化锰)的晶胞结构如图所示,晶胞参数为0.3851nm。该氮化锰的密度为![]() (列出计算式)。________________________________________________________
(列出计算式)。________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:

(1)浸锰过程中Fe2O3与SO2反应的化学方程式为Fe2O3+ SO2+2H+=2Fe2++ SO42-+ H2O,该反应是经历以下两步反应实现的。写出ⅱ的离子方程式:_____________。
ⅰ:Fe2O3 + 6H+ = 2Fe3++3H2O
ⅱ:……
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为_____________(填离子符号)。
(3)写出氧化过程中MnO2与SO2反应的化学方程式:_________________。
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是_________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是___________________。

(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:___________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浓度均为2mol/LAgNO3与Cu(NO3)2溶液各0.5L混合,以铜电极进行电解,一段时间后,阴极上有1.6g铜析出。
(1)直流电源已输出__mol电子。
(2)溶液中c(Cu2+)为_mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可以通过不同化学反应分别制得B、C和D三种物质,结构简式如图所示:
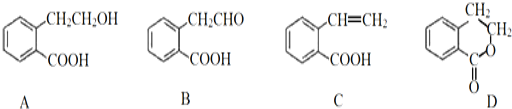
(1)A的分子式是__。
(2)A→B的反应类型是__;A→D中互为同分异构体的是__(填代号)。
(3)D在酸性条件下水解反应的化学方程式是__。
(4)写出C发生加聚反应的化学方程式__。
(5)检验B中醛基的方法__。
(6)符合下列条件的A的同分异构体有__种(用数字作答)。
①官能团种类不变且与苯环直接相连;②苯环上只有三个取代基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同的密闭容器中,用高纯度纳米级Cu2O分别进行催化分解水的实验:2 H2O(g)![]() 2 H2(g) + O2(g) H>0,实验测得反应体系中水蒸气浓度(mol·L-1)的变化结果如下:
2 H2(g) + O2(g) H>0,实验测得反应体系中水蒸气浓度(mol·L-1)的变化结果如下:
序号 | 时间/min | 0 | 10 | 20 | 30 | 40 | 60 |
① | 温度T1 / 1号Cu2O | 0.0500 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | 温度T1 / 2号Cu2O | 0.0500 | 0.0490 | 0.0483 | 0.0480 | 0.0480 | 0.0480 |
③ | 温度T2 / 2号Cu2O | 0.0500 | 0.0480 | 0.0470 | 0.0470 | 0.0470 | 0.0470 |
下列说法不正确的是( )
A. 实验时的温度T2高于T1
B. 2号Cu2O的催化效率比1号Cu2O的催化效率高
C. 实验①前20 min的平均反应速率v(O2) = 7×10ˉ5 mol·Lˉ1·minˉ1
D. 等质量纳米级Cu2O比微米级Cu2O催化效率高,这与Cu2O的粒径大小有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯),下列说法正确的是( )
Si(纯),下列说法正确的是( )
A.步骤①的化学方程式为SiO2+C![]() Si+CO2↑
Si+CO2↑
B.步骤①、②、③中每生成或反应1 mol Si,转移4 mol电子
C.二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D.SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com