
【题目】一定量的铁粉和9克硫粉混合加热,待其反应后再加入过量盐酸,将生成的气体完全燃烧,共收集得9克水,则加入的铁粉质量为
A.14gB.42gC.56gD.28g
【答案】D
【解析】
铁与硫加热发生反应:Fe+S ![]() FeS,若硫粉过量,加入盐酸发生反应:FeS+2HCl=FeCl2+H2S↑,H2S燃烧生成H2O;若铁粉过量时,Fe与盐酸还会反应:Fe+2HCl=FeCl2+H2↑,此时气体为H2S和H2;根据氢元素守恒分析解答。
FeS,若硫粉过量,加入盐酸发生反应:FeS+2HCl=FeCl2+H2S↑,H2S燃烧生成H2O;若铁粉过量时,Fe与盐酸还会反应:Fe+2HCl=FeCl2+H2↑,此时气体为H2S和H2;根据氢元素守恒分析解答。
9g水的物质的量为:n(H2O)=![]() =0.5mol,铁与硫粉加热发生反应为:Fe+S
=0.5mol,铁与硫粉加热发生反应为:Fe+S ![]() FeS,若硫粉过量,加入盐酸发生反应:FeS+2HCl=FeCl2+H2S↑,生成气体为H2S,H2S燃烧生成H2O和二氧化硫,根据氢元素守恒及反应方程式可知,n(Fe)=n(H2O);当铁粉过量时,Fe与盐酸还会反应:Fe+2HCl=FeCl2+H2↑,此时气体为H2S和H2,根据氢元素守恒及反应方程式可知,铁的物质的量与水的物质的量相等,即n(Fe)=n(H2O),因此生成水的物质的量与铁粉的物质的量相等,所以混合物中铁粉的物质的量为0.5mol,质量为:56g/mol×0.5mol=28g,故选D。
FeS,若硫粉过量,加入盐酸发生反应:FeS+2HCl=FeCl2+H2S↑,生成气体为H2S,H2S燃烧生成H2O和二氧化硫,根据氢元素守恒及反应方程式可知,n(Fe)=n(H2O);当铁粉过量时,Fe与盐酸还会反应:Fe+2HCl=FeCl2+H2↑,此时气体为H2S和H2,根据氢元素守恒及反应方程式可知,铁的物质的量与水的物质的量相等,即n(Fe)=n(H2O),因此生成水的物质的量与铁粉的物质的量相等,所以混合物中铁粉的物质的量为0.5mol,质量为:56g/mol×0.5mol=28g,故选D。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1molCnH2n分子中含共用电子对的数目为3nNA
B.标准状况下,11.2LCCl4中含有共用电子对的数目2NA
C.1L0.5mol/LNaHCO3溶液中所含HCO3-与CO32-数目之和为0.5NA
D.1mol/LFeCl3溶液中Fe3+数目小于1.0NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:

(1)表中元素,化学性质最不活泼的是________,只有负价而无正价的元素是________。
(2)C元素在元素周期表中的位置是第三周期第________族。
(3)最高价氧化物的水化物酸性最强的是________,呈两性的是________。
(4)A分别与E、G、H形成的化合物中,最稳定的是________。
(5)在B、C、E、F中,原子半径最大的是________。
(6)B、H两种元素所形成的化合物所含的化学键类型为________________。
(7)写出C的最高价氧化物与H的氢化物之间反应的离子方程式:__________________________。
(8)写出B与C两种元素的最高价氧化物对应的水化物相互反应的化学方程式:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入 NaOH 溶液的体积(V)的关系如图所示,下列说法正确的是
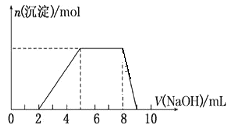
A.原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+
B.原溶液中 Al3+与NH4+的物质的量之比为 1∶3
C.反应最后形成的溶液中的溶质含AlCl3
D.原溶液中含有的阴离子是Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素在生活中有广泛应用,根据所需知识回答下列问题。
(1)氟元素基态原子的价电子排布图:_________,卤族元素位于元素周期表______区。
(2)在一定浓度的氢氟酸溶液中,部分溶质以二分子缔合(HF)2形式存在,使HF分子缔合的作用力是_______________。
(3)BF3常温下是气体,有强烈的接受弧电子对的倾向。BF3分子的立体构型为______,固态时的晶体类型是_______,BF3与NH3相遇立即生成白色固体,写出该白色固体物质的结构式并标注出其中的配位键_____。
(4)根据下表提供的数据判断,熔点最高、硬度最大的是_______(填化学式)。
离子晶体 | NaF | MgF2 | AlF3 |
晶格能(KJ·mol-1) | 923 | 2957 | 5492 |
(5)已知NaClO2晶体中阴离子为V型,ClO2-中氯原子的弧电子对数是______,ClO2-中氯原子的杂化轨道类型为_____,HClO4比HClO2酸性强的原因是_______。
(6)CaF2晶胞如下图所示。已知:NA为阿伏伽德罗常数,棱上相邻的两个Ca2+的核间距为acm,则CaF2的密度可表示为_____g·cm-3。
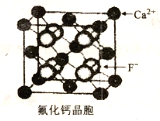
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.字母 A~K 代表常见物质,在一定条件下能发生如图所示变化
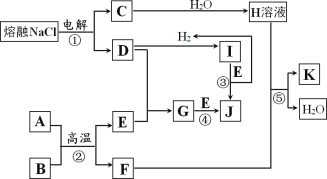
已知:反应②中A为红棕色粉末,B为金属单质,且n(A):n(B)=1:2,反应③和反应④均在水溶液中进行。
(1)保存 J 的方法是:_____。
(2)写出反应②的化学方程式:_____。
II.某研究性学习小组的同学以 Fe(NO3)3溶液来探究 Fe3+能否氧化 Ag 为题。他们选用少量的Fe(NO3)3 溶液与做过银镜反应的试管进行实验。现象:银镜部分溶解,试管上方出现少量淡淡的红棕色气体。
(1)出现少量淡淡的红棕色气体,该气体是_____。
(2)若 Fe3+能否氧化 Ag,只需证明:_____方法是:_____
Ⅲ. 铁红是一种红色颜料,其成分是 Fe2O3 ,将一定量的铁红溶于 180mL 5mol·L-1 盐酸中,在加入一定量铁粉恰好溶解,收集到 3.36L(标准状况)气体。
(1)按反应顺序写出离子方程式_____
(2)反应后的溶液中一定没有 Fe3+,理由是_____
(3)参加反应的铁粉的质量为_____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿佛加德罗常数的值,下列说法正确的是
A.标准状况下,NA个水分子所占体积约为22.4L
B.常温、常压下,22.4LN2所含的分子数小于NA个
C.在1mol Fe3O4中加入足量盐酸,反应中电子转移的总数为8/3 NA个
D.在标准状况下,Cl2和H2的混合气22.4L,光照后原子总数约为2NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋柳酯是一种镇咳祛痰药,用于上呼吸道感染、感冒咳嗽、急慢性支气管炎等的治疗,回答下列问题:
(1)醋柳酯的分子式为_____________________。
(2)关于醋柳酯的说法中,正确的是_________
A.核磁共振氢谱中只有6个吸收峰 B.能发生取代、加成、氧化反应
C.1mol该物质最多可以和7molH2反应 D.分子中所有原子一定在同一平面内
(3)醋柳酯可由下图所示路线合成:
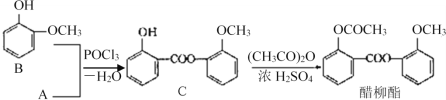
①A的结构简式为__________;中间产品C中混有反应物A和B,检验C中含有A的试剂是______________________。
②由C制醋柳酯的反应类型为____________________;写出C和足量NaOH溶液反应的化学方程式________。
③A的同分异构体很多,其中属于酯类、且能与FeCl3溶液反应显紫色的同分异构体有__种,写出一种的结构简式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物用途广泛。某矿渣的主要成分是![]() (铁酸镍)、NiO、FeO、CaO、
(铁酸镍)、NiO、FeO、CaO、![]() 等,以下是从该矿渣中回收
等,以下是从该矿渣中回收![]() 的工艺路线:
的工艺路线:
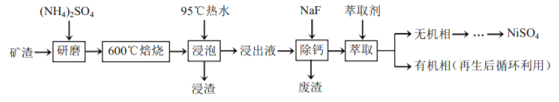
已知:![]() 在350℃以上会分解生成
在350℃以上会分解生成![]() 和
和![]() 。
。![]() 在焙烧过程中生成
在焙烧过程中生成![]() 、
、![]() 。锡(Sn)位于第五周期第ⅣA族。
。锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与![]() 混合研磨,混合研磨的目的是________。
混合研磨,混合研磨的目的是________。
(2)“浸泡”过程中![]() 生成
生成![]() 的离子方程式为________,“浸渣”的成分除
的离子方程式为________,“浸渣”的成分除![]() 、
、![]() 外还含有________(填化学式)。
外还含有________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入![]() 将
将![]() 还原为
还原为![]() ,所需
,所需![]() 的物质的量不少于
的物质的量不少于![]() 物质的量的________倍;除去过量的
物质的量的________倍;除去过量的![]() 后,再用酸性
后,再用酸性![]() 标准溶液滴定溶液中的
标准溶液滴定溶液中的![]() ,还原产物为
,还原产物为![]() ,滴定时反应的离子方程式为________。
,滴定时反应的离子方程式为________。
(4)“浸出液”中![]() ,当除钙率达到99%时,溶液中
,当除钙率达到99%时,溶液中![]() ________
________![]() [已知
[已知![]() ]
]
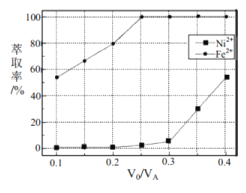
(5)本工艺中,萃取剂与溶液的体积比(![]() 对溶液中
对溶液中![]() 、
、![]() 的萃取率影响如图所示,
的萃取率影响如图所示,![]() 的最佳取值是________。
的最佳取值是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com