
【题目】某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入 NaOH 溶液的体积(V)的关系如图所示,下列说法正确的是
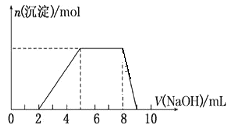
A.原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+
B.原溶液中 Al3+与NH4+的物质的量之比为 1∶3
C.反应最后形成的溶液中的溶质含AlCl3
D.原溶液中含有的阴离子是Cl-、AlO2-
【答案】B
【解析】
向溶液中滴加NaOH溶液时先没有沉淀生成,说明溶液中含有H+,溶液呈酸性,则溶液中不存在AlO2,当H+完全反应后继续滴加NaOH溶液,有沉淀生成,当沉淀最大时继续滴加NaOH溶液,沉淀的物质的量不变,说明NaOH和NH4+反应,则溶液中一定含有NH4+,当NH4+完全反应后继续滴加NaOH溶液,沉淀逐渐减小最终消失,说明溶液中含有Al3+,不含Mg2+,最终溶液中溶质为NaCl、NH3![]() H2O和NaAlO2,据此分析解答。
H2O和NaAlO2,据此分析解答。
向溶液中滴加NaOH溶液时先没有沉淀生成,说明溶液中含有H+,溶液呈酸性,则溶液中不存在AlO2,当H+完全反应后继续滴加NaOH溶液,有沉淀生成,当沉淀最大时继续滴加NaOH溶液,沉淀的物质的量不变,说明NaOH和NH4+反应,则溶液中一定含有NH4+,当NH4+完全反应后继续滴加NaOH溶液,沉淀逐渐减小最终消失,说明溶液中含有Al3+,不含Mg2+,最终溶液中溶质为NaCl、NH3![]() H2O和NaAlO2;
H2O和NaAlO2;
A.通过以上分析知,原溶液中一定含有的阳离子有H+、Al3+、NH4+,故A错误;
B.根据图象知,Al3+、NH4+消耗NaOH的物质的量之比为3:3,根据Al3++3OH=Al(OH)3↓、NH4++OH=NH3![]() H2O知,原溶液中Al3+与NH4+的物质的量之比1:3,故B正确;
H2O知,原溶液中Al3+与NH4+的物质的量之比1:3,故B正确;
C.通过以上分析知,最终得到的溶液中溶质为NaCl、NH3![]() H2O和NaAlO2,故C错误;
H2O和NaAlO2,故C错误;
D.通过以上分析知,原来溶液呈酸性,则一定不存在弱酸根离子AlO2,故D错误;
故答案选B。


科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A.氯化铝溶液与氨水反应:Al3++3OH-=Al(OH)3↓
B.铜与氯化铁溶液反应:2Fe3++3Cu=2Fe+3Cu2+
C.氧化镁与稀硝酸反应:MgO+2H+=Mg2++H2O
D.稀硫酸与氢氧化钡溶液反应:![]() +Ba2+=BaSO4↓
+Ba2+=BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,是元素周期表的一部分,请回答下列问题。
① | He | ||||||
Li | X | ② | ③ | Ne | |||
Na | Y | Z | Ar | ||||
(1)请画出图中元素Y的原子结构示意图___。
(2)如图为元素周期表的一部分:X、Y、Z代表三种不同元素,以下判断正确的是(______)
A.质子数:Y>Z
B.核外电子数:X=Y
C.Y和Z位于同一周期
(3)下列各组原子具有相似化学性质的是(______)
A.He、Mg
B.O、S
C.Cl、Ar
(4)2019年4月,《自然》杂志发文宣布科学家首次在太空中检测到氦合氢离子(HeH+),1个HeH+有__个电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语或物质的性质描述正确的是( )

A. 如图的键线式表示烃的名称为3-甲基-4-乙基-7-甲基辛烷
B. 符合分子式为C3H8O的醇有三种不同的结构
C. 乙烯在一定条件下能发生加成反应、加聚反应,被酸性高锰酸钾溶液氧化,也能在一定条件下被氧气氧化成乙酸
D. 治疗疟疾的青蒿素的结构简式为 ,分子式是C15H20O5
,分子式是C15H20O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,若W原子的最外层电子数是内层电子总数的![]() ,下列说法中正确的是
,下列说法中正确的是

A.阴离子的半径从大到小排列顺序为 X>Y>Z>W
B.X、Y、Z、W 元素的氢化物分子间都可以形成氢键
C.Y 的两种同素异形体在常温下可以相互转化
D.最高价氧化物对应的水化物的酸性:W>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去):
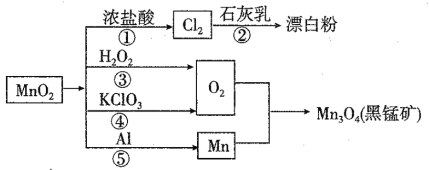
A. 反应①②③④⑤均属于氧化还原反应和离子反应
B. 反应⑤说明该条件下铝的氧化性强于锰
C. 生成等量的O2,反应③和④转移的电子数之比为1:2
D. 反应①中氧化剂与还原剂的物质的量之比为1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的铁粉和9克硫粉混合加热,待其反应后再加入过量盐酸,将生成的气体完全燃烧,共收集得9克水,则加入的铁粉质量为
A.14gB.42gC.56gD.28g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产铅蓄电池时,在两极板上的铅、锑合金棚架上均匀涂上膏状的PbSO4,干燥后再安装,充电后即可使用,发生的反应是2PbSO4+2H2O![]() PbO2+Pb+2H2SO4。下列对铅蓄电池的说法错误的是( )
PbO2+Pb+2H2SO4。下列对铅蓄电池的说法错误的是( )
A.需要定期补充硫酸
B.工作时铅是负极,PbO2是正极
C.工作时负极上发生的反应是Pb-2e-+SO42-=PbSO4
D.工作时电解质溶液的密度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物有许多用途。回答下列问题:
(1)基态![]() 原子的电子排布式为________,锰的第三电离能比铁的第三电离能大,这是因为________________________________________________________。
原子的电子排布式为________,锰的第三电离能比铁的第三电离能大,这是因为________________________________________________________。
(2)![]() 的沸点(71℃)比
的沸点(71℃)比![]() 的沸点(25.7℃)高,主要原因是______________________。
的沸点(25.7℃)高,主要原因是______________________。
(3)根据价层电子对互斥理论,![]() 、
、![]() 、
、![]() 三种微粒中,中心原子价层电子对数不同于其他微粒的是_______。
三种微粒中,中心原子价层电子对数不同于其他微粒的是_______。
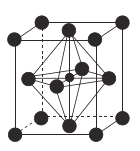
(4)![]() (氮化锰)的晶胞结构如图所示,晶胞参数为0.3851nm。该氮化锰的密度为
(氮化锰)的晶胞结构如图所示,晶胞参数为0.3851nm。该氮化锰的密度为![]() (列出计算式)。________________________________________________________
(列出计算式)。________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com