
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,若W原子的最外层电子数是内层电子总数的![]() ,下列说法中正确的是
,下列说法中正确的是

A.阴离子的半径从大到小排列顺序为 X>Y>Z>W
B.X、Y、Z、W 元素的氢化物分子间都可以形成氢键
C.Y 的两种同素异形体在常温下可以相互转化
D.最高价氧化物对应的水化物的酸性:W>Z
【答案】D
【解析】
W原子的最外层电子数是内层电子总数的![]() ,应为Cl,由元素在周期表中的位置可知X为N元素,Y为O元素,Z为S元素,据此分析结合元素性质解答。
,应为Cl,由元素在周期表中的位置可知X为N元素,Y为O元素,Z为S元素,据此分析结合元素性质解答。
根据分析,W为Cl元素,X为N元素,Y为O元素,Z为S元素,
A.同周期元素随核电荷数增大半径逐渐减小,原子核外电子层数越多,离子半径越大,应为Z>W>X>Y,故A错误;
B.S、Cl的非金属性较弱,氢化物分子间不存在氢键,故B错误;
C.Y为O,对应的两种同素异形体分别为O2、O3,在放电条件下可以相互转化,故C错误;
D.W为Cl元素,Z为S元素,元素的非金属性越强,对应的最高价氧化物对应的水化物的酸性越强,非金属性Cl>S,最高价氧化物对应的水化物的酸性:W>Z,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】2-甲基-1,3-丁二烯是一种重要的化工原料。可以发生以下反应。
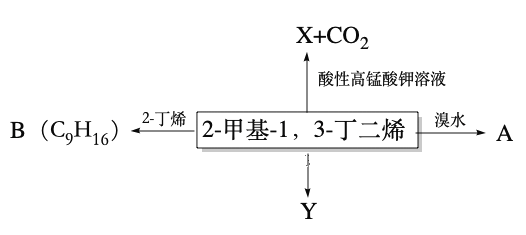
已知:
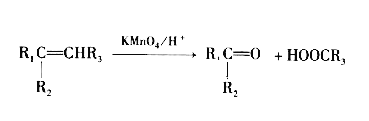
请回答下列问题:
(1)2-甲基-1,3-丁二烯与溴水发生加成反应。
① 完全加成所得有机产物的结构简式______________________________;
② 发生1,2-加成所得有机产物的化学方程式为 __________________________________;
③ 发生1,4-加成反应的名称为__________________。
(2)B为含有六元环的有机物,写出2-甲基-1,3-丁二烯与2-丁烯反应的化学方程式___________________________ 。
(3)Y(![]() )是天然橡胶的主要成分,能发生的反应有___________填标号)。
)是天然橡胶的主要成分,能发生的反应有___________填标号)。
A.加成反应 B.氧化反应 C.消去反应 D.酯化反应
(4)X的分子式为C3H4O3,其结构简式为_________________; X与丙醇发生酯化反应的化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下图两种化合物的结构或性质描述正确的是( )
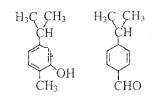
A.是同分异构体
B.分子中共平面的碳原子数一定相同
C.均能与溴水反应,不能使酸性高锰酸钾褪色
D.可用红外光谱区分,但不能用核磁共振氢谱区分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:

(1)表中元素,化学性质最不活泼的是________,只有负价而无正价的元素是________。
(2)C元素在元素周期表中的位置是第三周期第________族。
(3)最高价氧化物的水化物酸性最强的是________,呈两性的是________。
(4)A分别与E、G、H形成的化合物中,最稳定的是________。
(5)在B、C、E、F中,原子半径最大的是________。
(6)B、H两种元素所形成的化合物所含的化学键类型为________________。
(7)写出C的最高价氧化物与H的氢化物之间反应的离子方程式:__________________________。
(8)写出B与C两种元素的最高价氧化物对应的水化物相互反应的化学方程式:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化碘(IC13)在药物合成中用途非常广泛。已知ICl3熔点33℃,沸点73℃,有吸湿性,遇水易水解。某小组同学用下列装置制取ICl3(部分夹持和加热装置省略)。
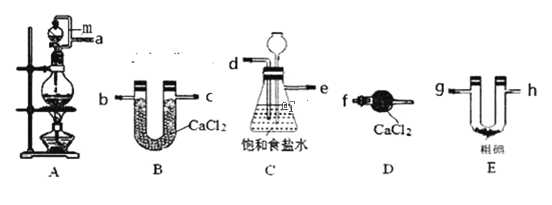
(1)按照气流方向连接接口顺序为a→___。装置A中导管m的作用是___。
(2)烧瓶中发生反应的离子方程式___,若移除酒精灯为了使反应能顺利进行烧瓶中可以放___。
(3)装置C用于除杂,同时作为安全瓶,能监测实验进行时后续装置是否发生堵塞,若发生堵塞C中的现象为___。
(4)氯气与单质碘需在温度稍低于70℃下反应,则装置E适宜的加热方式为___。装置E中发生反应的化学方程式为___。
(5)该装置存在的明显缺陷是___。
(6)粗碘的制备流程为:

操作Y用到的玻璃仪器有烧杯、___,操作Z的名称为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入 NaOH 溶液的体积(V)的关系如图所示,下列说法正确的是
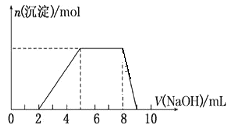
A.原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+
B.原溶液中 Al3+与NH4+的物质的量之比为 1∶3
C.反应最后形成的溶液中的溶质含AlCl3
D.原溶液中含有的阴离子是Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素在生活中有广泛应用,根据所需知识回答下列问题。
(1)氟元素基态原子的价电子排布图:_________,卤族元素位于元素周期表______区。
(2)在一定浓度的氢氟酸溶液中,部分溶质以二分子缔合(HF)2形式存在,使HF分子缔合的作用力是_______________。
(3)BF3常温下是气体,有强烈的接受弧电子对的倾向。BF3分子的立体构型为______,固态时的晶体类型是_______,BF3与NH3相遇立即生成白色固体,写出该白色固体物质的结构式并标注出其中的配位键_____。
(4)根据下表提供的数据判断,熔点最高、硬度最大的是_______(填化学式)。
离子晶体 | NaF | MgF2 | AlF3 |
晶格能(KJ·mol-1) | 923 | 2957 | 5492 |
(5)已知NaClO2晶体中阴离子为V型,ClO2-中氯原子的弧电子对数是______,ClO2-中氯原子的杂化轨道类型为_____,HClO4比HClO2酸性强的原因是_______。
(6)CaF2晶胞如下图所示。已知:NA为阿伏伽德罗常数,棱上相邻的两个Ca2+的核间距为acm,则CaF2的密度可表示为_____g·cm-3。
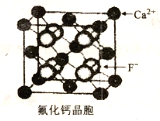
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿佛加德罗常数的值,下列说法正确的是
A.标准状况下,NA个水分子所占体积约为22.4L
B.常温、常压下,22.4LN2所含的分子数小于NA个
C.在1mol Fe3O4中加入足量盐酸,反应中电子转移的总数为8/3 NA个
D.在标准状况下,Cl2和H2的混合气22.4L,光照后原子总数约为2NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下进行甲、乙、丙三组实验。三组实验各取同浓度的盐酸30mL,加入同一种镁铝合金粉末,产生气体。有关数据列表如下(气体体积均为标准状况下测得):
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 255 | 385 | 459 |
气体体积/mL | 280 | 336 | 336 |
(1)乙组实验中,盐酸_____________(填“过量”、“适量”或“不足量”),理由是_________。
(2)要计算盐酸的物质的量浓度,题中可做计算依据的是____。
(3)合金中Mg、Al的物质的量之比为_________________。
(4)在丙组实验后,向容器中加入1mol/L的NaOH溶液,能使合金中的铝恰好溶解,不形成铝的沉淀,并使Mg2+刚好沉淀完全,求所加NaOH溶液的体积。(写出计算过程)_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com