
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去):
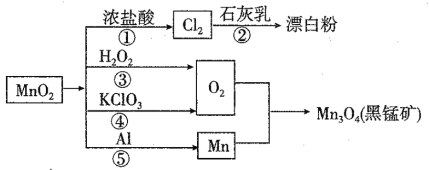
A. 反应①②③④⑤均属于氧化还原反应和离子反应
B. 反应⑤说明该条件下铝的氧化性强于锰
C. 生成等量的O2,反应③和④转移的电子数之比为1:2
D. 反应①中氧化剂与还原剂的物质的量之比为1:4
【答案】C
【解析】
A.①为二氧化锰与浓盐酸反应生成氯气、氯化锰、水,②为氯气与石灰乳反应生成氯化钙、次氯酸钙、水,③为过氧化氢分解生成水和氧气,④为氯酸钾分解生成氯化钾和氧气,⑤为铝和二氧化锰反应铝热反应生成Mn和氧化铝;
B.⑤为铝热反应,Al失去电子,为还原剂;
C.③中O元素的化合价由-1价升高为0,④中O元素的化合价有-2价升高为0;
D.①中Mn元素的化合价有+4价降低为+2价,HCl中Cl元素的化合价由-1价升高为0.
A、①为二氧化锰与浓盐酸反应生成氯气、氯化锰、水,②为氯气与石灰乳反应生成氯化钙、次氯酸钙、水,③为过氧化氢分解生成水和氧气,④为氯酸钾分解生成氯化钾和氧气,⑤为铝和二氧化锰反应铝热反应生成Mn和氧化铝,均存在元素的化合价变化,均属于氧化还原反应,③④⑤中没有离子参加反应,故A错误;
B、⑤为铝热反应,Al失去电子,为还原剂,Mn为还原产物,则还原性Al>Mn,故B错误;
C、③中O元素的化合价由-1价升高为0,④中O元素的化合价有-2价升高为0,则相同条件下生成等量的O2,反应③和④转移的电子数之比为1:2,故C正确;
D、反应①4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O中Mn元素的化合价由+4价降低为+2价,HCl中Cl元素的化合价由-1价升高为0,由电子守恒可知,氧化剂与还原剂的物质的量之比为1:2,故D错误;
MnCl2+Cl2↑+2H2O中Mn元素的化合价由+4价降低为+2价,HCl中Cl元素的化合价由-1价升高为0,由电子守恒可知,氧化剂与还原剂的物质的量之比为1:2,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】下列除杂试剂的选择或除杂操作正确的是( )
选项 | 括号内为杂质 | 除杂试剂 | 除杂操作 |
A | CO2(SO2) | 饱和Na2CO3溶液 | 将气体通过足量的Na2CO3溶液 |
B | Na2O2(Na2O)固体 | O2 | 在纯氧气中加热 |
C | NO2(NO) | H2O | 将气体通入水中 |
D | NH3(H2O) | 浓硫酸 | 气体通入浓硫酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述不正确的是( )
A. 在K37ClO3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若有212克氯气生成,则反应中电子转移的数目为5NA
B. 常温下,向等浓度、等体积的Na2CO3和NaHCO3溶液中滴加等量的酚酞溶液,碳酸钠溶液中红色更深,证明阴离子水解常数Kh: CO32->HCO3-
C. 含0.2molH2SO4的浓硫酸与足量Zn完全反应,转移的电子数目可能为0.3NA
D. 标准状况下,33.6L Cl2与足量CH4在光照条件下充分反应,生成的C-Cl键数目为3.0NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列陈述I、Ⅱ正确并且有因果关系的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 干燥的氯气有强氧化性 | 氯水能使有色布条褪色 |
B | SO2是酸性氧化物 | SO2可使含有酚酞的NaOH溶液褪色 |
C | 盐酸和氨水能溶解Al(OH)3 | Al(OH)3是两性氢氧化物 |
D | 用淀粉-KI溶液鉴别FeCl2 | Fe2+有氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ亚铁氰化钾K4[Fe(CN)6],俗名黄血盐,可溶于水,不溶于乙醇。它是一种食品添加剂,我们所食用的部分食盐中就添加了亚铁氰化钾作为抗结剂。如果食用过量,易引起胃肠适。同学们可以观察一下家中食盐的配料表,尽量选用不含抗结剂的食盐。亚铁氰化钾可用如下方法进行制备。
已知HCN是一种极弱的酸,现有一种用含NaCN的废水合成黄血盐的主要工艺流程如下:
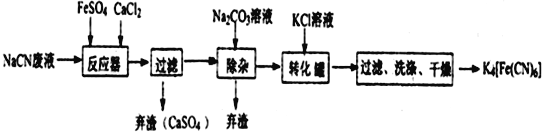
(1)常温下,NaCN水溶液的pH_______7(填“>”、“<”、“ = ”)。
(2)反应器中发生的主要反应的化学方程式为_____________________________。
(3)流程中加入Na2CO3溶液后过滤除去弃渣,过滤需要的玻璃仪器有烧杯、漏斗、______________。
(4)转化器中生成K4[Fe(CN)6]的反应类型是_______________,相同温度下,溶解度:K4[Fe(CN)6]___________Na4[Fe(CN)6](填“>”“ = ”“<”)。
(5)实验室常用K4[Fe(CN)6]检验Fe3+,生成难溶盐KFe[Fe(CN)6],试写出上述反应的离子方程式为_____________________________。
Ⅱ亚铁氰化钾也可以用硫酸亚铁铵为原料制备。可以用氧化还原滴定法测定晶体中Fe2+的含量。称取一份质量为20.0g 的硫酸亚铁铵晶体样品,制成溶液。用0.5 mol/L KMnO4溶液滴定,当溶液中Fe2+全部被氧化,MnO4- 被还原成Mn2+时,耗KMnO4 溶液体积20.00mL。
滴定时,将KMnO4 溶液装在____(酸式或碱式) 滴定管中,判断反应到达滴定终点的现象为__________ ;晶体中FeSO4的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的分类正确的是( )
A. 氯水、水玻璃、明矾都是混合物
B. CO2、NO2、P2O5均为酸性氧化物
C. 根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
D. 根据分散系粒子直径的大小将分散系分为溶液、胶体和浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜矿石的主要成分是Cu2O,还含有少量的Al2O3、Fe2O3和SiO2。某工厂利用此矿石炼制精铜的工艺流程如图所示(已知:Cu2O+2H+=Cu+Cu2++H2O)。
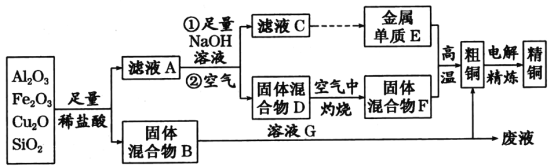
(1)滤液A中铁元素的存在形式为______________(填离子符号),生成该离子的离子方程式为____________________________________________________________________,
(2)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为_____________,
在实验室中完成此实验还需要的试剂是________。
a.KClO3 b.KCl c.Mg d.MnO2
(3)溶液G与固体混合物B反应的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
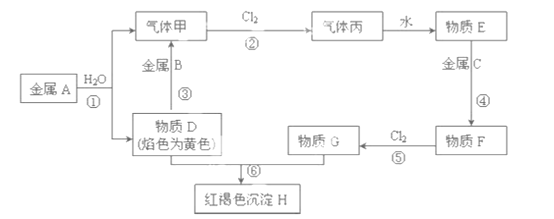
请回答下列问题:
(1)物质B的化学式为:_____________________。
(2)气体甲在Cl2中燃烧的现象:___________________________;
(3)金属A与G的水溶液反应的化学方程式:_____________________;
(4)写出下列反应的离子方程式:
③:______________________________________.
⑤:_______________________________________.
(5)将Na2O2投入到F溶液中,可以观察到的现象是:______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com