
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)这九种元素中,位于第三周期且原子半径最小元素的原子结构示意图_____________。
(2)④、⑤、⑧三种元素中,离子半径由大到小的顺序为__________(填离子符号)。
(3)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是
⑧和⑨元素的气态氢化物稳定性顺序为_____________________(填化学式)。
(4)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为____________________________。
(5)①、④、⑤、⑨四种元素中,某些元素间可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式____________。
(6)元素⑤与元素④能形成原子个数比为1:1的化合物Y,Y在常温下为固态,焰色反应为黄色,Y与②的最高价氧化物反应的化学方程式为_____________,②的最高价氧化物的电子式___________。
(7)能说明⑧的非金属性比⑨的非金属性__________(填“强”或“弱”)的事实是________(用离子方程式说明)。
【答案】 S2->O2->Na+ H2SO4>H2CO3>H2SiO3 HCl>H2S 2Al+2OH-+2H2O =2AlO2-+3H2
S2->O2->Na+ H2SO4>H2CO3>H2SiO3 HCl>H2S 2Al+2OH-+2H2O =2AlO2-+3H2 ![]() 或
或![]() 2Na2O2+2CO2=2Na2CO3+ O2
2Na2O2+2CO2=2Na2CO3+ O2 ![]() 弱 Cl2+S2-=S+2Cl-
弱 Cl2+S2-=S+2Cl-
【解析】
由元素在周期表中的位置可知,①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为S、⑨为Cl。
(1)根据同周期,从左到右,原子半径逐渐减小判断;
(2)电子层越多,离子半径越大,具有相同电子排布的离子,原子序数大的离子半径小;
(3)非金属性越强,对应最高价含氧酸的酸性越强;非金属性越强,对应氢化物越稳定;
(4)⑥单质与⑤的最高价氧化物的水化物反应生成偏铝酸钠和氢气;
(5)①、④、⑤、⑨四种元素中某些元素形成的既含离子键又含极性共价键的化合物可以是NaOH或NaClO;
(6)元素⑤与元素④能形成原子个数比为1∶1的化合物为过氧化钠,②的最高价氧化物为二氧化碳;
(7)非金属单质之间的置换反应可说明非金属性强弱。
(1)同周期,从左到右,原子半径逐渐减小,九种元素中,位于第三周期且原子半径最小元素为氯,其原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)电子层越多,离子半径越大,电子层结构相同的离子,核电荷数越大,离子半径越小,④、⑤、⑧三种元素中,离子半径由大到小的顺序为S2->O2->Na+,故答案为:S2->O2->Na+;
(3)元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,非金属性Cl>S>C>Si,②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是H2SO4>H2CO3>H2SiO3;非金属性越强,对应氢化物越稳定性,⑧和⑨元素的气态氢化物稳定性顺序为HCl>H2S,故答案为:H2SO4>H2CO3>H2SiO3;HCl>H2S;
(4)⑤的最高价氧化物的水化物为氢氧化钠,铝与氢氧化钠反应生成偏铝酸钠和氢气,离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)①、④、⑤、⑨四种元素中,某些元素间可形成既含离子键又含极性共价键的化合物为NaOH或NaClO,电子式为![]() 或
或![]() ,故答案为:
,故答案为:![]() 或
或![]() ;
;
(6)元素⑤与元素④能形成原子个数比为1∶1的化合物Y,Y在常温下为固态,焰色反应为黄色,Y为过氧化钠,②的最高价氧化物为二氧化碳,二者反应生成碳酸钠和氧气,反应的方程式为2Na2O2+2CO2=2Na2CO3+O2,二氧化碳的电子式为![]() ,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
,故答案为:2Na2O2+2CO2=2Na2CO3+O2;![]() ;
;
(7)同周期元素从左到右,非金属性逐渐增强,非金属性S<Cl,可以通过非金属单质之间的置换反应说明非金属性强弱,即Cl2+S2-=S+2Cl-说明非金属性S<Cl,,故答案为:弱;Cl2+S2-=S+2Cl-。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在不同温度下按照相同物质的量投料发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0,测得CO的平衡转化率与压强的关系如图所示,有关说法正确的
CH3OH(g) △H<0,测得CO的平衡转化率与压强的关系如图所示,有关说法正确的
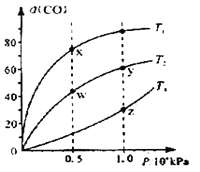
A. 混合气体密度:ρ(x)=ρ(w)
B. 正反应速率:υ正(y)=υ正(w)
C. 反应温度:T1>T2
D. 混合气体平均摩尔质量:M(y)<M(Z)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)
①若![]() 为强碱,则
为强碱,则![]() 也为强碱
也为强碱
②若![]() 为强酸,则Y是活泼非金属元素
为强酸,则Y是活泼非金属元素
③若Y的最低化合价为-2,则Z的最高正化合价可能为+7
④若X的最高正化合价为+5,则五种元素都是非金属元素
⑤若Z的氧化物对应的水化物为HZO3,则Z的最外层电子数可能不为5
A. ②③⑤ B. ①②③ C. ②③ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去)。当X是强碱时, B能使湿润的红色石蕊试纸变蓝。下列说法中不正确的是
![]()
A. 当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B. 当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C. B和Cl2的反应是氧化还原反应
D. 当X是强酸时,C在常温下是气态单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤正确的是
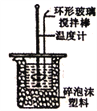
A. 为了减小热量损失,倒入NaOH溶液应该多次迅速倒人
B. 用套在温度计上的环形玻璃搅拌棒上下轻轻地搅动
C. 烧杯如不盖硬纸板,不影响测得的中和热数值
D. 先用一支温度计测量盐酸温度,再用另一支温度计测量氢氧化钠溶液温度,并做好记录
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备和A中加热装置已省略)。
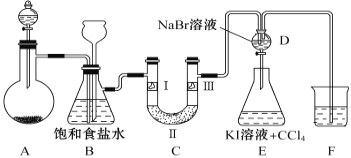
请回答:
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,相关反应的化学方程为________________。
(2)装置B中饱和食盐水的作用是____________。同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象___________________________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入_______。
选项 | Ⅰ | Ⅱ | Ⅲ |
A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
B | 干燥的有色布条 | 硅胶 | 湿润的有色布条 |
C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)装置F烧杯中盛放的试剂是_______________。
(5)设计装置D、E的目的是比较Cl2、Br2、I2的氧化性强弱。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为橙黄色,说明Cl2的氧化性大于Br2。打开装置D的活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是________________________________________。该现象_____________(填“能”或“不能”)说明Br2 的氧化性强于I2 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A的分子式为C9H15OCl,分子中含有一个六元环和一个甲基,环上只有一个取代基;F分子中不含甲基:A与其它物质之间的转化如下图所示:

(1)A-F的反应类型是____;G中含氧官能团的名称是____。
(2)A-C的反应方程式是________。
(3)H的结构简式是________,E的结构简式是____。
(4)有的同学认为B中可能没有氯原子,你的观点是________(填“同意”或“不同意”)你的理由_______。
(5)某烃的含氧衍生物X符合下列条件的同分异构体中,核磁共振氢谱显示为2组峰的是_____(写结构简式);只含有两个甲基的同分异构体有____种。
①相对分子质量比C少54;②氧原子数与C相同 ; ③能发生水解反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将碳酸钠和碳酸氢钠的固体混合物Wg溶于水制成500mL溶液,钠离子的物质的量浓度为0.8mol·L-1,若将Wg该混合物用酒精灯加热至质量不再改变时,得到的固体物质的质量可能是
A. 21.2g B. 6.2g C. 8.4g D. 10.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关科学家及其创建理论的描述中,错误的是( )
A. 汤姆生提出葡萄干面包式模型 B. 道尔顿创立分子学说
C. 门捷列夫发现了元素周期律 D. 卢瑟福提出了核式原子模型
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com