
【题目】
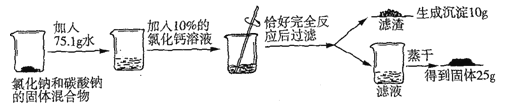
(1)写出上述反应的化学方程式_______________________;
(2)试列出求解混合物中碳酸钠的质量(x)的比例式_______________;
(3)原固体混合物中氯化钠的质量为_______________;
(4)反应后所得滤液中溶质的质量数为_______________;
(5)若工业上用此混合物239t与熟石灰混合制取含杂质的烧碱产品100t,则制得烧碱产品杂质含量为_______________。
【答案】(1)Na2CO3+CaCl2=CaCO3↓+2NaCl;(2)106:100=xg:10g;
(3)13.3g;(4)12.5%;(5)20%。
【解析】试题分析:(1)碳酸钠与氯化钙混合,发生反应:Na2CO3+CaCl2=CaCO3↓+2NaCl,产生白色沉淀;(2)根据方程式可知:每反应产生100份CaCO3沉淀,会反应消耗106份Na2CO3,所以混合物中碳酸钠的质量(x)的比例式是106:100=xg:10g; (3) 根据混合物中碳酸钠的质量(x)的比例式是106:100=xg:10g,可知原混合物中含有碳酸钠的质量是10.6g,根据方程式Na2CO3+CaCl2=CaCO3↓+2NaCl可知:每反应产生100份的CaCO3,同时会产生117份的NaCl,则发生上述反应产生的NaCl的质量是(117÷100)×10g=11.7g,所以原固体混合物中氯化钠的质量为25g-11.7g=13.3g;(4)原固体的质量是m="10.6g" +3.3g=13.9g,加入水的质量是75.1g,反应析出CaCO3质量是10g,由于CaCl2溶液的质量分数是10%,根据钙元素守恒可知加入CaCl2的质量是m(CaCl2)=0.1mol×111g/mol÷10%=111g;反应后溶液的质量是m=111g+75.1g+10.6g+13.3g10g =200g,溶质NaCl的质量是25g,所以反应后所得滤液中溶质的质量分数为:(25g÷200g)×100%=12.5%;(5) 设生成氢氧化钠的质量为m,
Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH
106 80
![]() m
m
106:![]() =80:m,解得m=80t,
=80:m,解得m=80t,
所以制得烧碱产品杂质含量为:[(100t80t)÷100t]×100%=20%。


 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】(10分)I、按要求书写热化学方程式:
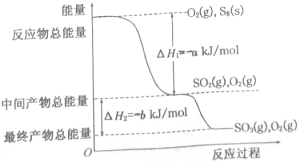
(1)下图为N2(g)和02(g)生成NO(g)过程中的能量变化:

NO(g)分解生成N2(g)和O2(g)的热化学方程式为___________________;
(2)化合物AX3和单质X2在一定条件下反应可生成化合物AX5。己知AX3的熔点和沸点分别为为-93.6℃和76℃,AX5的熔点为167℃,室温时,AX3与气体X2反应生成1mol AX5,放出热量123.8kJ.该反应的热化学方程是为______.
II、已知单质硫在通常条件下以S8(斜方硫)的形式存在,而在蒸气状态时,含有S2、S4、S6及S8等多种同素异形体,其中S4、S6和S8具有相似的结构特点,其结构如下图所示:

在一定条件下,S8(s)和O2(g)发生反应依次转化为S02(g)和S03(g)。反应过程和能量关系可用下图简单表示(图中的△H表示生成1mol产物的数据)。
(3)写出表示S8燃烧热的热化学方程式_________________。
(4)写出SO3分解生成SO2和O2的热化学方程式___________________。
(5)若已知S-O键的键能为dkJ/mol,O=O键的键能为ekJ/mol,则S8分子中S-S键的键能为_______kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 配置一定物质的量浓度的溶液时,需要用到玻璃棒、胶头滴管
B. 用湿润的pH试纸测量稀氢氧化钠溶液的pH,测量值偏大
C. 可用焰色反应鉴别氯化钠和碳酸钠
D. 用分液的方法从含有少量氯化钠的硝酸钾溶液中提取硝酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol Na与乙醇完全反应,失去2 NA个电子
B.常温常压下,8 g CH4含有5 NA个电子
C.1 L 0.1 mol·L-1的醋酸溶液中含有0.1 NA个H+
D.标准状况下,22.4 L苯含有NA个C6H6分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(11分)请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497 kJ·mol-1.N2(g)+O2(g)=2NO(g)△H=+180.0kJ·mol-1。则相同条件下破坏化学键需要吸收的能量为_______kJ。
(2)25℃时,pH=5的CH3COOH溶液中.由水电离出的氢离子浓度c(H+)=________ kJ·mol-1;往溶液中加入少量NaOH固体,则溶液中![]() _______(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:_______。
_______(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:_______。
(3)25℃下,向某Na2CO3溶液中加入稀盐酸,其中含碳元素的各种微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。

①在同一溶液中,H2CO3、HCO3-、CO32-______(填“能”或“不能”)大量共存。
②当pH =7时,溶液中含碳元素的微粒主要为________。溶液中各种离子的物质的量浓度大小关系为______________。
③反应的CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=______________________。
HCO3-+OH-的平衡常数Kh=______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定质量的石灰石(杂质不溶于水,也不与酸反应)高温煅烧一段时间后得111.2g固体,向其中加入500g质量分数为14.6%的稀盐酸继续有气泡产生,至固体不再减少时过滤,得一定质量的中性溶液和20g不溶物(滤渣),则煅烧和加入盐酸两次反应产生气体的质量比为
A.1:1 B.1:2 C.1:3 D.1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,将a g NH3完全溶于水,得到V mL pH=8的氨水,假设该氨水的密度为ρ g·cm-3,溶质的质量分数为ω,其中含NH![]() 的物质的量为b mol,下列叙述中一定正确的是( )
的物质的量为b mol,下列叙述中一定正确的是( )
A. 溶质的质量分数为ω=![]() ×100%
×100%
B. 溶质的物质的量浓度c=![]() mol·L-1
mol·L-1
C. 溶液中c(OH-)=![]() mol· L-1
mol· L-1
D. 上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5 ω
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com