
【题目】下列各化合物中,阳离子与阴离子半径之比最小的是( )
A. LiI B. LiF C. NaCl D. KBr
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴加一滴Na2S溶液并振荡,沉淀又变成黑色。根据上述变化过程,分析此三种沉淀物的溶解度关系为( )
A. AgCl=AgI=Ag2S B. AgCl<AgI<Ag2S
C. AgCl>AgI>Ag2S D. AgI>AgCl>Ag2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中所有原子都满足最外层为8电子结构的是( )
① BeCl ② NC13③ PCl5④ COC12⑤ SF6⑥ XeF2⑦ CS2 ⑧CH4⑨CF2C12⑩ S2C12
A. ②④⑦⑧⑧⑨⑩ B. ②④⑦⑨⑩ C. ③④⑦⑩ D. ③④⑤⑦⑨⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为2S2Cl2+2H2O=SO2↑+3S↓+4HCl
.下列说法中错误的是

A.S2Cl2为含有极性键和非极性键的非极性分子
B.反应中SO2是氧化产物,S是还原产物
C.S2Cl2的分子构型与H2O2的分子构型相似
D.反应中,生成3molS,转移电子数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期A、B、C、D、E5种主族元素,-子序数依次增大,A是元素周期表中原子半径最小元素,B元素最高价氧化物分子式为B2O5;C的阴离子和D的阳离子具有相同的电子层结构,E的L层电子数等于K、M两个电子层上电子数之和。
(1)元素:A为 ,B为
(2)E在周期表中的位置为
(3)C、D两元素的单质反应,生成一种淡黄色的固体F,则F的化学式为是 ,属于 化合物(填“离子”或“共价”),该化合物中阴阳离子数比为
(4)单质C怎能溶于元素B最高价氧化物对应水化物的稀溶液,请写出该反应离子方程式
(5)E 的一种氧化物为酸雨的“罪魁祸首”。设计一实验证明某气体为E 的该氧化物,并写出该氧化物与足量NaOH的反应离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图用石墨作电极的电解池中,放入500 mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6 g。

请回答下列问题;
(1)A接的是电源的________极,B是该装置______极
(2)写出电解时反应的总离子方程式_______________
(3)电解后溶液的pH为________;要使电解后溶液恢复到电解前的状态,则需加入________,其质量为________。(假设电解前后溶液的体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
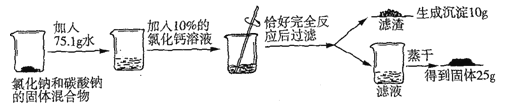
(1)写出上述反应的化学方程式_______________________;
(2)试列出求解混合物中碳酸钠的质量(x)的比例式_______________;
(3)原固体混合物中氯化钠的质量为_______________;
(4)反应后所得滤液中溶质的质量数为_______________;
(5)若工业上用此混合物239t与熟石灰混合制取含杂质的烧碱产品100t,则制得烧碱产品杂质含量为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于原电池和电解池的叙述正确的是( )
A.原电池中失去电子的电极为阴极
B.原电池的负极、电解池的阳极都发生氧化反应
C.原电池的两极一定是由活动性不同的两种金属组成
D.电解时电解池的阴极一定是阴离子放电
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com