
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为2S2Cl2+2H2O=SO2↑+3S↓+4HCl
.下列说法中错误的是

A.S2Cl2为含有极性键和非极性键的非极性分子
B.反应中SO2是氧化产物,S是还原产物
C.S2Cl2的分子构型与H2O2的分子构型相似
D.反应中,生成3molS,转移电子数目为3NA
【答案】A
【解析】
试题分析:A、由结构可知,S2Cl2分子中S原子之间形成1对共用电子对,Cl原子与S原子之间形成1对共用电子对,分子中S-S为非极性键,S-Cl键为极性键,S2Cl2是展开书页型结构,Cl-S位于两个书页面内,该物质结构不对称,正负电荷重心不重合,为极性分子,A错误;B、S2Cl2硫化合价由+1降低为0价硫,所以S为还原产物,S2Cl2硫化合价由+1升高为+4价SO2,所以SO2为氧化产物,B正确;C、根据结构图可知S S2Cl2的分子构型与H2O2的分子构型相似,C正确;D、在反应中,S元素发生自身氧化还原反应,S2Cl2硫化合价由+1升高为+4价SO2,所以生成1molSO2,转移电子为3mol,D正确;答案选A。


科目:高中化学 来源: 题型:
【题目】下列各组气体,经充分反应后,原来的气体有剩余的是 ( )
A.1molNH3和1molHCl混合
B.1molNO和0.5molO2混合
C.1molSO2和1molH2S混合
D.等体积的NO和NO2被足量烧碱溶液吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)I、按要求书写热化学方程式:
(1)下图为N2(g)和02(g)生成NO(g)过程中的能量变化:

NO(g)分解生成N2(g)和O2(g)的热化学方程式为___________________;
(2)化合物AX3和单质X2在一定条件下反应可生成化合物AX5。己知AX3的熔点和沸点分别为为-93.6℃和76℃,AX5的熔点为167℃,室温时,AX3与气体X2反应生成1mol AX5,放出热量123.8kJ.该反应的热化学方程是为______.
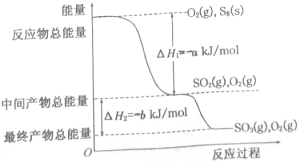
II、已知单质硫在通常条件下以S8(斜方硫)的形式存在,而在蒸气状态时,含有S2、S4、S6及S8等多种同素异形体,其中S4、S6和S8具有相似的结构特点,其结构如下图所示:

在一定条件下,S8(s)和O2(g)发生反应依次转化为S02(g)和S03(g)。反应过程和能量关系可用下图简单表示(图中的△H表示生成1mol产物的数据)。
(3)写出表示S8燃烧热的热化学方程式_________________。
(4)写出SO3分解生成SO2和O2的热化学方程式___________________。
(5)若已知S-O键的键能为dkJ/mol,O=O键的键能为ekJ/mol,则S8分子中S-S键的键能为_______kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)把0.2mol X气体和0.4mol Y气体混合于2L密闭容器中,使它们发生如下反应:![]() 末生成0.3mol W。若测知Z的浓度变化表示的反应速率为0.05mol
末生成0.3mol W。若测知Z的浓度变化表示的反应速率为0.05mol ![]() 。计算:
。计算:
①前2min内用Y 的浓度变化表示的反应速率为 ![]()
②化学方程式中n的值是 。
(2)在一定温度下,将4mol SO2与2mol O2放入4L的密闭容器中,在一定条件下反应,2SO2+O2![]() 2SO3。10min 时达到平衡状态。此时容器内压强比反应前减少20%,计算SO2的转化率为 。
2SO3。10min 时达到平衡状态。此时容器内压强比反应前减少20%,计算SO2的转化率为 。
(3)某温度时在2L容器中A、B、C 三种气态物质的物质的量(n)随时间(l)变化的曲线如图所示,由图中数据分析:

①该反应的化学方程式为
②下列叙述能说明上述反应达到平衡状态的是 。
A、混合气体的总物质的量不随时间的变化而变化
B、相同时间内消耗2n mol 的A的同时生成4nmol 的C
C、混合气体的总质量不随时间的变化而变化
D、容器内压强不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修3:物质结构与性质】
氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合韧是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为 ,该能层具有的原子轨道数为 ;
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2![]() 2NH3,实现储氢和输氢。下列说法正确的是 ;
2NH3,实现储氢和输氢。下列说法正确的是 ;
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH+4与PH+4、CH4、BH-4、ClO—4互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.[Cu(NH3)4]2+离子中,N原子是配位原子
(3)用价层电子对互斥理论推断SnBr2分子中,Sn原子的轨道杂化方式为 ,SnBr2分子中 Sn-Br的键角 120°(填“>”“<”或“=”)。
(4)NiO 的晶体结构与氯化钠相同, 在晶胞中镍离子的配位数是____________。 已知晶胞的边长为 a nm, NiO 的摩尔质量为 b g·mol-1, NA为阿伏加德罗常数的值, 则NiO 晶体的密度为_________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2=Na2S2O5
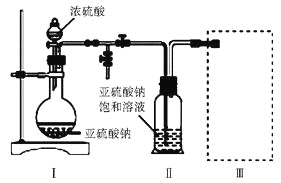
(1)装置Ⅰ中产生气体的化学方程式为____________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是____________。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为______(填字母)。
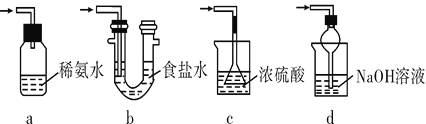
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO![]() 的电离程度大于水解程度,可采用的实验方法是________(填字母)。
的电离程度大于水解程度,可采用的实验方法是________(填字母)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验,是检验__________的存在(填离子符号)。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)

①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为____________g·L-1。
②在上述实验过程中,若有部分HI被空气中氧化氧化,则测得结果________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 配置一定物质的量浓度的溶液时,需要用到玻璃棒、胶头滴管
B. 用湿润的pH试纸测量稀氢氧化钠溶液的pH,测量值偏大
C. 可用焰色反应鉴别氯化钠和碳酸钠
D. 用分液的方法从含有少量氯化钠的硝酸钾溶液中提取硝酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,将a g NH3完全溶于水,得到V mL pH=8的氨水,假设该氨水的密度为ρ g·cm-3,溶质的质量分数为ω,其中含NH![]() 的物质的量为b mol,下列叙述中一定正确的是( )
的物质的量为b mol,下列叙述中一定正确的是( )
A. 溶质的质量分数为ω=![]() ×100%
×100%
B. 溶质的物质的量浓度c=![]() mol·L-1
mol·L-1
C. 溶液中c(OH-)=![]() mol· L-1
mol· L-1
D. 上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5 ω
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com