
【题目】【化学-选修3:物质结构与性质】
氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合韧是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为 ,该能层具有的原子轨道数为 ;
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2![]() 2NH3,实现储氢和输氢。下列说法正确的是 ;
2NH3,实现储氢和输氢。下列说法正确的是 ;
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH+4与PH+4、CH4、BH-4、ClO—4互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.[Cu(NH3)4]2+离子中,N原子是配位原子
(3)用价层电子对互斥理论推断SnBr2分子中,Sn原子的轨道杂化方式为 ,SnBr2分子中 Sn-Br的键角 120°(填“>”“<”或“=”)。
(4)NiO 的晶体结构与氯化钠相同, 在晶胞中镍离子的配位数是____________。 已知晶胞的边长为 a nm, NiO 的摩尔质量为 b g·mol-1, NA为阿伏加德罗常数的值, 则NiO 晶体的密度为_________g·cm-3。
【答案】(1)M;9(2)cd(3)sp2杂化;<(4)6;4b×1021/(a3.NA)
【解析】
试题分析:(1)Ti为22号元素,在基态Ti2+中含20个电子,由构造原理可知,在基态Ti2+中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9;
(2)a、根据VESPR模型可知NH3分子中氮原子的轨道杂化方式为sp3杂化,a错误;b、等电子体为价电子数和原子数相同的分子、离子或原子团,BH4-和ClO4-不是等电子体,b错误;c、由于NH3中存在氢键,相同压强时,NH3的沸点比PH3的沸点高,c正确;d、[Cu(NH3)4]2+中,N原子有孤对电子是配位原子,d正确;答案选cd;
(3)由价层电子对互斥理论,SnBr2分子中,a=4,x=2,b=1,中心原子上的孤电子对数=1/2(a-xb)=1,Sn原子的轨道杂化方式为SP2杂化,VESPR模型为平面三角形,为120°,去掉孤电子对,为V型,孤对电子的斥力使SnBr2分子中Sn—Br的键角减小,小于120°;
(4)NiO的晶体结构与氯化钠相同,在晶胞中镍离子的配位数是6。已知晶胞的边长为a nm,NiO的摩尔质量为b gmol-1,NA为阿伏加德罗常数的值,在一个晶胞中,其体积为a3 nm3,在一个晶胞中含有4个Ni和4个O,一个晶胞的质量为4b/NAg,晶体的密度为(4b×1021)/(a3×NA)gcm-3。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的可再生能源。
(1)已知2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH =a KJ/mol
CO(g)+2H2(g)=CH3OH(g) ΔH =b KJ/mol
试写出由CH4和O2制取甲醇的热化学方程式: 。
(2)还可以通过下列反应制备甲醇:CO(g)+2H2(g) ![]() CH3OH(g)。
CH3OH(g)。
甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示平均反应速率v(H2)= 。
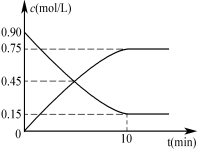
甲图
(3)在一容积可变的密闭容器中充入10 mol CO和20 mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如乙图所示。

乙图
①下列说法能判断该反应达到化学平衡状态的是_______。(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍 B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA________PB(填“>、<、=”)。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10molCO和20 molH2,则在平衡状态B时容器的体积V(B)= L。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。若KOH溶液足量,则写出电池总反应的离子方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015安徽理综化学】下列有关说法正确的是 ( )
A.在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解
B.Fe(OH)3胶体无色、透明,能发生丁达尔现象
C.H2、SO2、CO2三种气体都可用浓硫酸干燥
D.SiO2既能和氢氧化钠溶液反应也能和氢氟酸反应,所以是两性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中所有原子都满足最外层为8电子结构的是( )
① BeCl ② NC13③ PCl5④ COC12⑤ SF6⑥ XeF2⑦ CS2 ⑧CH4⑨CF2C12⑩ S2C12
A. ②④⑦⑧⑧⑨⑩ B. ②④⑦⑨⑩ C. ③④⑦⑩ D. ③④⑤⑦⑨⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图:

(1)若A为Zn,B为石墨棒,电解质溶液为稀硫酸,写出负极的电极反应式
(2)若A为铜片,B为石墨棒,电解质为FeCl3溶液,则铜片为 极(填正或负),写出正极电极反应式
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,该电池的总反应为 。当外电路有6.02X1022 个电子通过,则该电池正极消耗气体(标准状况) L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为2S2Cl2+2H2O=SO2↑+3S↓+4HCl
.下列说法中错误的是

A.S2Cl2为含有极性键和非极性键的非极性分子
B.反应中SO2是氧化产物,S是还原产物
C.S2Cl2的分子构型与H2O2的分子构型相似
D.反应中,生成3molS,转移电子数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期A、B、C、D、E5种主族元素,-子序数依次增大,A是元素周期表中原子半径最小元素,B元素最高价氧化物分子式为B2O5;C的阴离子和D的阳离子具有相同的电子层结构,E的L层电子数等于K、M两个电子层上电子数之和。
(1)元素:A为 ,B为
(2)E在周期表中的位置为
(3)C、D两元素的单质反应,生成一种淡黄色的固体F,则F的化学式为是 ,属于 化合物(填“离子”或“共价”),该化合物中阴阳离子数比为
(4)单质C怎能溶于元素B最高价氧化物对应水化物的稀溶液,请写出该反应离子方程式
(5)E 的一种氧化物为酸雨的“罪魁祸首”。设计一实验证明某气体为E 的该氧化物,并写出该氧化物与足量NaOH的反应离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图用石墨作电极的电解池中,放入500 mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6 g。

请回答下列问题;
(1)A接的是电源的________极,B是该装置______极
(2)写出电解时反应的总离子方程式_______________
(3)电解后溶液的pH为________;要使电解后溶液恢复到电解前的状态,则需加入________,其质量为________。(假设电解前后溶液的体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 电解饱和食盐水可制得黄绿色的氯气
B. 镁条着火时,不可用二氧化碳灭火
C. 工业炼铁时,用焦炭直接还原氧化铁得到铁单质
D. 浓硫酸具有吸水性等特性,是因为浓硫酸中硫酸主要以分子形式存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com