
����Ŀ���״���һ����Ҫ�Ŀ�������Դ��
��1����֪2CH4(g)+O2(g)=2CO(g)+4H2(g) ��H =a KJ/mol
CO(g)+2H2(g)=CH3OH(g) ��H =b KJ/mol
��д����CH4��O2��ȡ�״����Ȼ�ѧ����ʽ�� ��
��2��������ͨ�����з�Ӧ�Ʊ��״���CO(g)+2H2(g) ![]() CH3OH(g)��
CH3OH(g)��
��ͼ�Ƿ�ӦʱCO��CH3OH(g)��Ũ����ʱ��ı仯������ӷ�Ӧ��ʼ����ƽ�⣬��H2��ʾƽ����Ӧ����v(H2)= ��
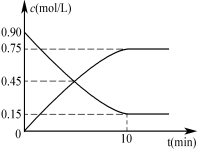
��ͼ
��3����һ�ݻ��ɱ���ܱ������г���10 mol CO��20 mol H2��CO��ƽ��ת�������¶ȣ�T����ѹǿ��P���ı仯����ͼ��ʾ��

��ͼ
������˵�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����_______��������ĸ��
A��H2���������ʵ���CH3OH���������ʵ�2�� B��H2������������ٸı�
C����ϵ��H2��ת���ʺ�CO��ת�������
D����ϵ�������ƽ��Ħ���������ٸı�
���Ƚ�A��B����ѹǿ��СPA________PB��������������=������
�����ﵽ��ѧƽ��״̬Aʱ�����������Ϊ20 L�������Ӧ��ʼʱ�Գ���10molCO��20 molH2������ƽ��״̬Bʱ���������V(B)= L��
��4���Լ״�Ϊȼ�ϣ�����Ϊ��������KOH��ҺΪ�������Һ�����Ƴ�ȼ�ϵ�أ��缫����Ϊ���Ե缫������KOH��Һ��������д������ܷ�Ӧ�����ӷ���ʽ��__________��
���𰸡�28.��12�֣�
(1) 2CH4(g)+O2(g)=2CH3OH(g) ��H=(a+2b)kJ/mol (2��)
(2) 0.15mol/(L��min)(2��)
(3)��BD(2��) ����(2��) ��14 L(2��)
(4)2CH3OH+3O2+4OH-=2CO32-+6H2O(2��)
��������
�����������1����2CH4(g)+O2(g)=2CO(g)+4H2(g) ��H =a KJ/mol����CO(g)+2H2(g)=CH3OH(g) ��H =b KJ/mol�����ݸ�˹��������+����2����H=(a+2b)kJ/mol��������CH4��O2��ȡ�״����Ȼ�ѧ����ʽΪ2CH4(g)+O2(g)=2CH3OH(g) ��H=(a+2b)kJ/mol��
��2����ͼ���֪���ӷ�Ӧ��ʼ����ƽ����CO�����ʵ���Ũ�ȼ�����0.90-0.15=0.75mol/L�����ݻ�ѧ����ʽ��������Ũ�ȼ�����0.75mol/L��2=1.5mol/L��������H2��ʾƽ����Ӧ����v(H2)=1.5mol/L��10min=0.15mol/(L��min).
��3����A��H2����������ָ��������Ӧ���ʣ���CH3OH����������ָ��Ҳ������Ӧ���ʣ�����˵����Ӧ�ﵽƽ��״̬������ B��H2������������ٸı䣬˵��������Ũ�ȱ��ֲ��䣬��˵����Ӧ�ﵽƽ��״̬����ȷ��C�������ϵ���ȼ������Ӧ�����ƽ�������ϵ��H2��ת���ʺ�CO��ת���ʶ�����ȣ�����D���÷�Ӧ���������������С�Ŀ��淴Ӧ������M=m��n�����ŷ�Ӧ�Ľ��У��ܱ��������������䣬���ʵ�����С������ϵ�������ƽ��Ħ���������ٸı䣬˵����Ӧ�ﵽƽ��״̬����ȷ����ѡBD��
��A��B�����¶���ͬ����A��B��CO��ƽ��ת�������ߣ�˵����Ӧ������Ӧ������У�������ѹǿʱ��ƽ��������Ӧ�����ƶ�����A��B����ѹǿ��СPA<PB��
����ѹǿP1�����£�CO��ƽ��ת����Ϊ0.5����ƽ��ʱCOΪ5mol������10mol���״�5mol���ܹ�20mol����ѹǿP2�����£�CO��ƽ��ת����Ϊ0.8����ƽ��ʱCOΪ2mol������4mol���״�8mol���ܹ�14mol����Ϊ��ͬ�����£��������������ʵ��������ȣ�����20:20=14:V�����V=14L.
��4���ڼ״�ȼ�ϵ���У���Ӧԭ���Ǽ״�ȼ������CO2��ˮ�����ڵ������Һ��KOH��Һ�����ɵ�CO2��KOH��Ӧ����̼��غ�ˮ����������ܷ�Ӧ�����ӷ���ʽΪ2CH3OH+3O2+4OH-=2CO32-+6H2O��


 �������¿��ÿ�ʱ��ҵϵ�д�
�������¿��ÿ�ʱ��ҵϵ�д� Ӣ�żƻ�ͬ����ʱ��Чѵ��ϵ�д�
Ӣ�żƻ�ͬ����ʱ��Чѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeS2�Ľṹ������Na2O2����һ�ֹ�������ᷴӦʱ����H2S2, H2S2������H2O2����:H2S2=H2S+S��ʵ������ϡ������ȡH2Sʱ��ijѧ����FeS2��������FeSʹ�ã�����Ӧ����������ɵ�������( )
A��H2S B��S C��FeS D��FeCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ǿ�������Һ���ֱ������������������еĸ�һ�֣����һ����ظ���NH![]() ��Ba2+��Na+��H+��SO
��Ba2+��Na+��H+��SO![]() ��NO
��NO![]() ��OH����CO
��OH����CO![]() ������������Һ�ֱ���ΪA��B��C��D����������ʵ�飺
������������Һ�ֱ���ΪA��B��C��D����������ʵ�飺
����A��D�е���C�����г������ɣ���D��B��Ӧ���ɵ������ܱ�A���գ���A��D��Ӧ���ɵ������ܱ�B���ա��Իش��������⣺
(1)D�Ļ�ѧʽ��___________���ж�������_______________��
(2)д�����༸�����ʵĻ�ѧʽ��A__________��B___________��C____________��
(3)д��ʵ�������йط�Ӧ�����ӷ���ʽ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������뻯ѧ�����йص�˵����ȷ���ǣ� ��
A. Na2O��CaO��Al2O3������������
B. Һ�岻���磬����Һ���Ƿǵ����
C. 12C��13C�ĺ�������Ų���ʽ��ͬ����ѧ������ͬ
D. ֻ�����ۼ�������һ���ǹ��ۻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ҩ�ﱴŵ����������ˮ����Ͷ�������������һ�������·�Ӧ�Ƶ�:
 +
+
![]()
 +H2O
+H2O
�����й�������ȷ���� (����)
A����ŵ�������������ֺ���������
B������FeCl3��Һ��������ˮ����Ͷ�����������
C������ˮ����Ͷ����������Ӿ�����NaHCO3��Һ��Ӧ
D����ŵ��������NaOH��Һ����,������������ˮ�����ƺͶ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������壬����ַ�Ӧ��ԭ����������ʣ����� ( )
A��1molNH3��1molHCl���
B��1molNO��0.5molO2���
C��1molSO2��1molH2S���
D���������NO��NO2�������ռ���Һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڲ�ͬ�¶��£�ˮ��Һ��c(H+)��c(OH��)����ͼ��ʾ��ϵ�����������������ӹ���˵������ȷ����

A. a���Ӧ����ɫ��Һ���ܴ������ڣ�Fe3+��Na+��Cl-��SO42-
B. b���Ӧ����Һ���ܴ������ڣ�NH4+��Ca2+��AlO2-��I-
C. c���Ӧ����Һ���ܴ������ڣ�Na+��Ba2+��Cl-��CO32-
D. d���Ӧ����Һ���ܴ������ڣ�Na+��K+��SO32-��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������100mL 1mol/L��������Ƭ�ķ�Ӧ����ȡ���д�ʩ��ʹ��Ӧ���ʼӿ���ǣ��� ��
�������¶ȣ�
������100mL 3mol/L���
������300mL 1mol/L���
���õ������۴�����Ƭ��
������98%������
A���٢ۢ� B���٢ڢ� C���٢ڢۢ� D���٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ-ѡ��3�����ʽṹ�����ʡ�
���ܵĴ洢������Ӧ�õ���Ҫƿ������λ�⻯��������廯������Ŀǰ�����õ���Ҫ������ϡ�
��1��Ti��BH4��2��һ�ֹ���Ԫ�����⻯�ﴢ����ϡ��ڻ�̬Ti2+�У�����ռ�ݵ�����ܲ����Ϊ �����ܲ���е�ԭ�ӹ����Ϊ ��
��2��Һ���Ǹ������ʣ������ܵ��������壬����N2+3H2![]() 2NH3,ʵ�ִ�������⡣����˵����ȷ���� ��
2NH3,ʵ�ִ�������⡣����˵����ȷ���� ��
a��NH3�����е�ԭ�ӵĹ���ӻ���ʽΪsp2�ӻ�
b��NH+4��PH+4��CH4��BH-4��ClO��4��Ϊ�ȵ�����
c����ͬѹǿʱ��NH3�ķе��PH3�ķе��
d��[Cu��NH3��4]2+�����У�Nԭ������λԭ��
��3���ü۲���ӶԻ��������ƶ�SnBr2�����У�Snԭ�ӵĹ���ӻ���ʽΪ ��SnBr2������ Sn-Br�ļ��� 120��(�������������=��)��
��4��NiO �ľ���ṹ���Ȼ�����ͬ�� �ھ����������ӵ���λ����____________�� ��֪�����ı߳�Ϊ a nm�� NiO ��Ħ������Ϊ b g��mol-1�� NAΪ�����ӵ�������ֵ�� ��NiO ������ܶ�Ϊ_________g��cm-3��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com